PARTIE AUTO-FORMATION
-
CHAPITRE 1. Imagerie par résonance magnétique (IRM)
L’IRM est une technique d’imagerie non invasive qui permet l’étude millimétrique du cerveau avec une haute résolution spatiale. En tant que méthode d’imagerie en coupe non ionisante, elle se distingue des autres techniques tomographiques, telles que le scanner à rayons X ou la tomographie par émission de positons, en étant fondée sur le phénomène de résonance magnétique nucléaire (RMN).
La résonance magnétique représente une réponse spécifique d’un noyau à une perturbation de son alignement lorsqu’il est soumis à un champ magnétique externe intense.
Ce phénomène a été démontré pour la première fois par des chercheurs en 1946 : Edward Mills Purcell à l’université d’Harvard et Felix Bloch à l’université de Stanford [2, 3].
L’acquisition des premières images en une dimension utilisant ce phénomène a été réalisé en 1950 par Herman Carr, qui introduit un gradient dans le champ magnétique. Les temps de relaxation T1 et T2, qui varient selon le type des tissus sains et des tissus pathologiques tumoraux, furent découverts en 1971.
En 1973, Paul Lauterbur proposa une méthode innovante basée sur le marquage spatial de spins à l’aide de plusieurs gradients de champs magnétiques, ainsi que sur les techniques de reconstruction d’images tomodensitométriques. Cela permit l’acquisition des premières images de résonance magnétique en deux dimensions. Deux ans plus tard, Ernst introduisit le codage de phase par variation de l’amplitude d’un gradient de champ magnétique, facilitant ainsi l’utilisation de la « transformée de Fourier » pour l’analyse du codage en fréquence du signal IRM. [5]
Par la suite, Peter Mansfield développa une méthode d’acquisition rapide connue sous le nom de technique d’écho-planaire (echo-planar imaging = EPI), réalisant la première image 3D en 1976. Lauterbur suivit avec la première image en trois dimensions du corps entier un an plus tard. Grâce à ces avancées, des images 3D in vivo sont désormais possibles avec l’IRM, offrant une très haute résolution spatiale.
De nombreuses modalités d’imagerie peuvent être réalisées avec un seul appareil IRM, notamment les images de diffusion des molécules d’eau (IRM de diffusion), les images anatomiques (IRM structurelle), l’imagerie des vaisseaux sanguins (angiographie IRM), la mesure du flux sanguin (IRM de perfusion), ainsi que l’imagerie des différents métabolites (spectroscopie IRM) et les images d’activité fonctionnelle (IRM fonctionnelle).
L’introduction des systèmes IRM cliniques (fig.1) a révolutionné la pratique de la radiologie. À ce jour, l’IRM continue de servir comme l’une des principales méthodes d’imagerie non invasive du corps humain.
L’objectif de cette première partie est donc de présenter brièvement les bases de l’imagerie par résonance magnétique tout en abordant ses applications cliniques et les enjeux contemporains liés à son utilisation.
Principes physiques de l’IRM
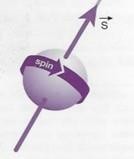
L’imagerie médicale, utilise en général, le noyau de l’atome d’hydrogène. Le noyau des atomes contient deux composants, les neutrons, qui sont neutres, et les protons qui ont une charge positive et assure un mouvement de rotation sur eux même appelé « spin » et possède alors une propriété d’aimant, il a donc un pôle nord et sud.
Chaque aimant peut aussi être appelé moment magnétique nucléaire. Le principe de l’IRM est basé sur ce mouvement de rotation. (fig.2)
Le noyau d’hydrogène est constitué d’un seul proton, il est très présent dans les systèmes biologiques. Bien qu’ils ne représentent que 10% de la masse corporelle, les atomes d’hydrogènes participent à 86% de la composition chimique de l’organisme répartie majoritairement dans les molécules d’eau et de graisse. L’hydrogène est donc un atome de choix pour l’étude des tissus biologiques notamment le cerveau humain.
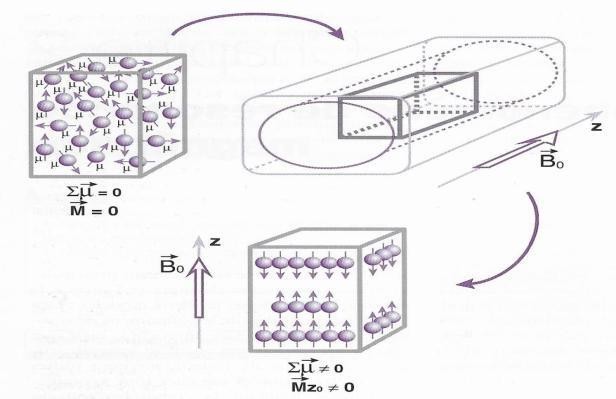
L’eau contient des protons de charge positive par nature, leur rotation induit un champ magnétique. En l’absence de champ magnétique externe, ces champs magnétiques sont répartis aléatoirement et ont tendance à s’annuler. Cependant en présence d’un champ magnétique externe intense (B0), les spins vont s’aligner parallèlement à ces champs.
Une première moitié va s’orienter dans le sens inverse du champ magnétique B0, appelé orientation antiparallèle et l’autre moitié est légèrement supérieure en nombre, va s’orienter dans le sens de B0, appelé orientation parallèle. Selon les lois de la thermodynamique, le nombre de spins ayant une orientation parallèle au champ B0 état de basse énergie, est sensiblement supérieur au nombre de spins antiparallèle au champ externe état de haute énergie. (fig.3)
Sous l’action d’un champ externe, les spins vont donc être orientés selon B0 mais chaque spin va avoir un mouvement de rotation autour de B0 en décrivant un cône, ce mouvement est appelé mouvement de précession de spin. (fig.4)
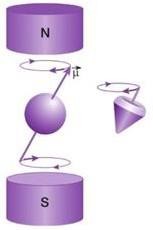
Ainsi les protons vont tourner autour de la direction de Bo à une certaine fréquence définie par une relation mathématique appelée « fréquence de Larmor » est liée au champ magnétique.
On remplace l’ensemble des spins individuels par un seul vecteur d’aimantation (M) qui va représenter l’ensemble des spins des particules comprises dans un voxel.
Les moments magnétiques ne pointent plus dans des directions aléatoires, l’aimantation totale du tissu biologique n’est plus nulle (M≠0), le tissu est donc aimanté. [4]
Phase d’excitation
L’aimantation de B0 étant très supérieur à celle de (M), il est impossible d’étudier (M) dans ces conditions. Il va donc falloir le dévier de l’axe de B0 afin de lui apporter une composante transversale Mxy. C’est uniquement à travers cette composante transversale que l’étude de M est possible, son aimantation n’étant plus « noyée » dans celle de B0 lors d’un apport d’énergie externe qu’on appelle « phase d’excitation ».
La seule manière de transmettre cette énergie est d’exploiter le phénomène de résonance pour transmettre de l’énergie à un système en équilibre, il faut l’apporter par une fréquence égale à sa fréquence de résonance. L’onde électromagnétique envoyée au système est appelée champ magnétique tournant (B1), ou onde radiofréquence (RF).
La différence en nombre d’atomes se compense entre les deux états d’énergie et les particules vont en absorber l’énergie nécessaire à faire changer le sens de leur spin et passer de l’état de basse énergie, à l’état de haute énergie.
Sous l’effet de l’onde RF, l’aimantation nette M va se mettre à précesser autour de B0 à la fréquence de Larmor. Plus la durée d’application de l’onde est importante plus l’angle de « bascule » (angle entre M et B0) va être important. Une impulsion dite de « 90° » va annuler la composante longitudinale Mz de M et maximiser sa composante transversale Mxy. Tous les spins sont alors en phase.
Une impulsion de 180°, appelé « impulsion d’inversion » va totalement inverser la composante longitudinale de M.
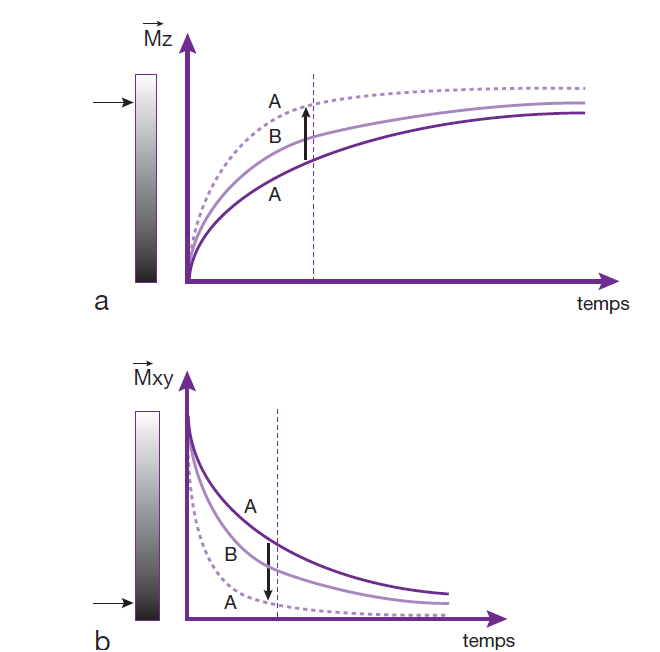
A l’arrêt de l’impulsion, les spins vont commencer à déphaser, et l’aimantation nette (M) va retourner à son état d’équilibre en pré cessant autour de B0. Le système va ensuite retourner à son état d’équilibre, c’est le phénomène de la relaxation. (fig.5)
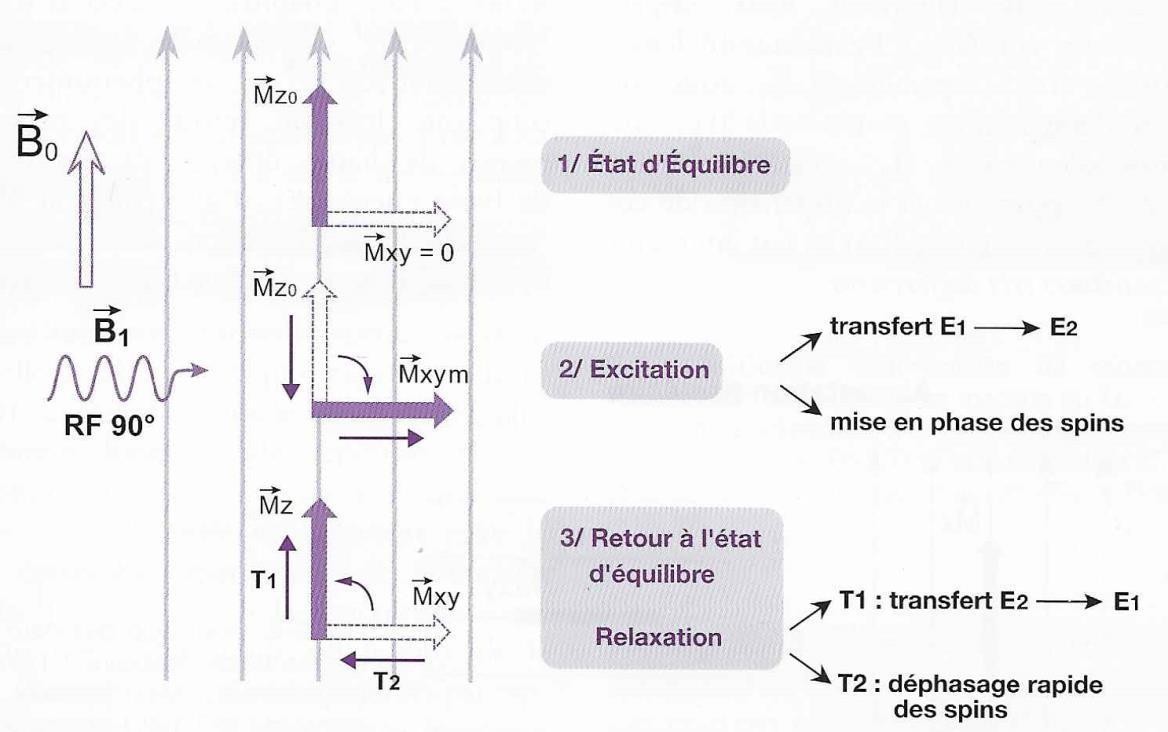
Phase de relaxation
La relaxation est un retour à l’équilibre non instantané elle ne se fait pas en ligne droite.
Pour une impulsion de 90°, M est à l’horizontale et ensuite petit à petit va aller à la verticale en tournant autour de Bo tout en se rapprochant de Bo.
C’est donc un mouvement complexe où l’on décrit séparément MT et ML:
- MT va s’annuler petit à petit, au départ elle est maximale et à la fin elle est nulle.
- ML est nulle au début de la relaxation puis elle va augmenter jusqu’à atteindre sa valeur d’équilibre avant la rupture de son équilibre, on parle de repousse de l’aimantation longitudinale
Comme l’aimantation tourne dans le plan horizontal, on peut mettre une antenne (soit une boucle de fil électrique) qui va détecter un courant (c’est le phénomène de courant induit). On peut enregistrer et analyser ce courant qui passe dans l’antenne, et on obtient un courant en forme de sinusoïde. Et comme MT diminue au cours du temps, il s’agit d’une sinusoïde décroissante.
Ce courant qu’on enregistre s’appelle le signal FID (Free Induction Decay).
A l’arrêt de l’impulsion radiofréquence, les particules retournent à leur état énergétique d’origine, c’est-à-dire alignées avec le champ externe B0, de l’état d’énergie le plus haut au plus faible.
Ce phénomène est accompagné par un transfert de l’énergie en excès aux particules voisines, qui est détecté par l’IRM. Elle est caractérisée par deux temps de relaxation T1 et T2 :
- Les images pondérées en T1 vont suivre la croissance de la composante longitudinale de M.
- Les images pondérées T2 vont suivre la décroissance de la composante transversale de M.
En IRM clinique, l’impulsion radiofréquence typiquement utilisée est celle correspondant à la fréquence de Larmor du noyau d’hydrogène. L’énergie libérée lors de la relaxation correspond à une estimation du nombre de protons qui est la quantité d’eau.
Temps de relaxation spin-réseau (T1) [7,8]
La relaxation T1 ou spin-réseau est le processus par lequel les protons échangent de l’énergie avec leur environnement pour revenir à leur état d’énergie inférieure et provoquer ainsi la restauration de l’aimantation longitudinale. La vitesse à laquelle cela se produit dépend de la vitesse de précession de la molécule avec laquelle interfère le proton. La relaxation spin-réseau dépend du tissu considéré et aussi du calibre des molécules du milieu (un milieu composé de grosses molécules favorisera l’échange d’énergie), T1 est aussi propre à chaque environnement moléculaire. Le temps caractéristique T1 est le temps qu’il faut à l’aimantation longitudinale pour retrouver 63% de son état initial après une impulsion de 90°. Ce temps T1 dépend aussi du champ magnétique externe B0. D’un point de vue quantique, plus la différence d’énergie entre les états de base et de haute énergie est importante, plus la dissipation d’énergie sera importante et plus le temps de relaxation sera prolongé. Ainsi en augmentant la puissance du champ, les valeurs de T1 augmentent.
Temps de relaxation spin-spin (T2) et (T2 *) [2,8]
En parallèle de la repousse de l’aimantation longitudinale Mz, on observe une disparition progressive de l’aimantation transversale Mxy du au déphasage des protons qui sera variable en fonction du tissu considéré. Ce déphasage des protons provient d’une interaction électromagnétique des protons entre eux, les spins ne donnent pas seulement leur énergie aux molécules voisines mais aussi aux spins voisins qui ne sont pas encore excités, on parle donc de relaxation « spin- spin ». Ce déphasage est la réflexion des inhomogénéités locales de champ magnétique qui est propre à la nature physico-chimique de chaque tissu. Ce processus est représenté par une fonction exponentielle plus ou moins marquée en fonction du tissu, qui est caractérisée par une autre constante de temps, la constante T2.
Les inhomogénéités propres à chaque tissu responsable de la relaxation spin-spin ne sont que très peu dépendantes du champ magnétique externe B0 mais dépendent principalement de la nature physico-chimique du milieu à étudier, et on aura à l’inverse du T1, les valeurs de T2 sont très peu dépendantes du champ B0.
Les valeurs T1 et T2 sont spécifiques à chaque type de tissu biologique.
Les différentes intensités présentes dans une image IRM proviennent de ces valeurs. La relaxation T2 * (étoile T2) est le nom donné pour décrire les effets qui résultent de la combinaison de la relaxation T2 et du déphasage résultant d’une inhomogénéité dans B0. La relaxation T2 * détermine le taux réel de décroissance observé lors de la mesure d’un signal de décroissance par induction libre (FID). T2 est une constante décrivant le temps nécessaire à l’aimantation transversale pour décroître jusqu’à environ 37% de sa valeur initiale. L’interaction spin – spin régit la vitesse de relaxation T2 et influence donc les valeurs T2 pour les différents tissus. L’eau libre (par exemple, le liquide céphalo- rachidien), comprenant de petites molécules se déplaçant rapidement et relativement éloignées, aura moins d’interaction spin-spin et donc des valeurs T2 plus longues par rapport aux tissus à base d’eau à forte teneur macromoléculaire (par exemple, matière grise), ce qui leur donne plus de temps pour interagir l’un à l’autre. La relaxation T2 peut se poursuivre avec ou sans perte d’énergie globale.
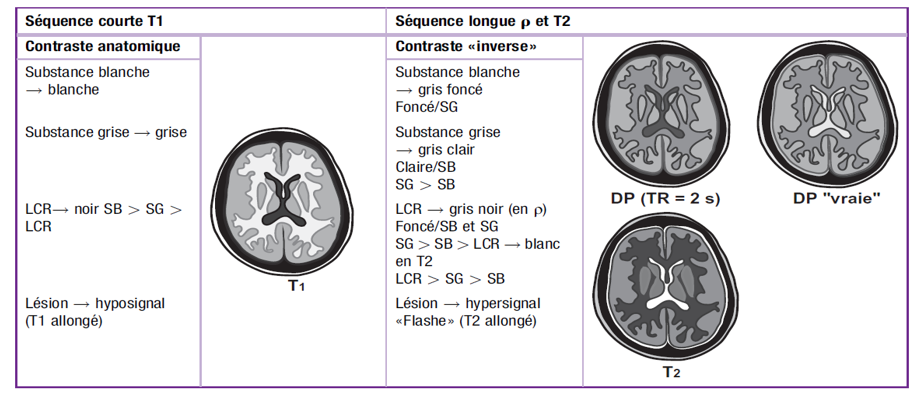
Pour les tissus humains, la relaxation transversale est généralement un processus beaucoup plus rapide que la relaxation longitudinale ; par conséquent, les valeurs T2 sont toujours inférieures ou égales à T1. Pour les tissus biologiques, T1 est environ 5 à 10 fois plus long que T2. (fig.6)
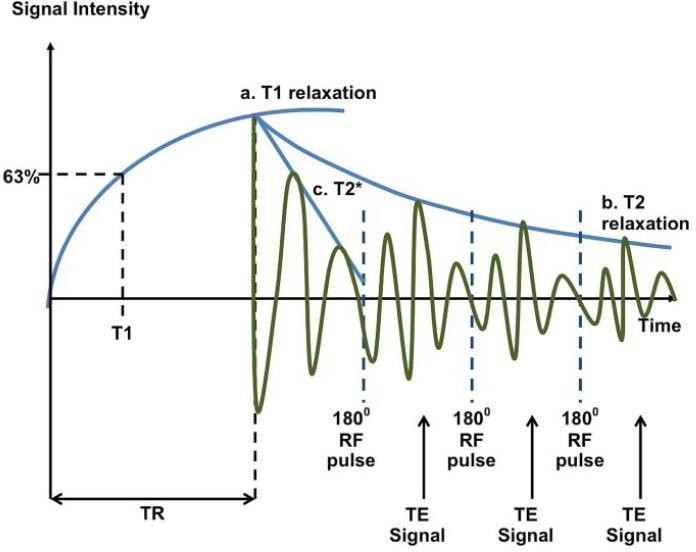
- Courbe T1: Le traçage du temps de récupération de l’aimantation longitudinale au fil du temps après l’arrêt d’une impulsion de radiofréquence (RF) dans une courbe T1.
- Courbe T2: une impulsion de recentrage à 180 ° agit pour « combattre » les effets de l’inhomogénéité du champ magnétique externe en rephasant le proton. Il en résulte un gain d’intensité temporaire du signal au temps d’écho (TE) appelé écho de spin. Une séquence d’impulsions à 180 ° se traduit par une chaîne d’échos de spin. Chaque écho ultérieur sera de moindre intensité en raison des effets T2. Une courbe reliant les intensités d’écho de spin est la courbe T2.
- Courbe T2 *: Cette courbe résulte lorsque des impulsions de recentrage à 180 ° ne sont pas utilisées.
- Le signal se désintègre beaucoup plus rapidement en raison des effets T2 *. TR, temps de répétition.
4- Séquences de base:
Il existe de nombreuses séquences d’imagerie qui ont été développées pour couvrir un très large champ d’application de l’IRM. Les deux méthodes principales, la séquence d’écho de spin qui est caractérisée par la présence d’une impulsion RF de 180°, et la séquence d’écho de gradient. Elles sont la base des autres séquences. Certaines séquences sont hybrides et mélangent écho de spin et écho de gradient.
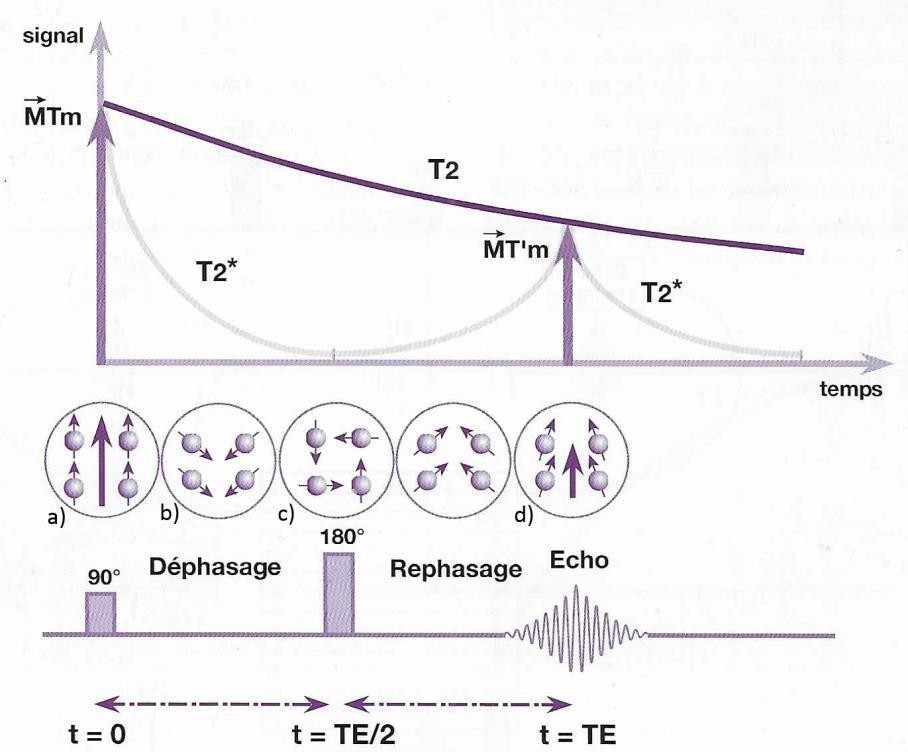
La séquence d’écho de spin [9,10]
La séquence d’écho de spin est la première séquence développée. Par l’application d’une impulsion radiofréquence de 180° au temps TE/2, elle permet de refocaliser les déphasages des spins dus aux hétérogénéités de champ constantes et ainsi obtenir un signal sans inhomogénéités pondéré en T2 (et non en T2*).
La séquence commence par basculer l’ensemble des spins de la tranche sélectionnée par l’application de l’impulsion radiofréquence de 90° simultanément avec le gradient de sélection de coupe. On applique ensuite les gradients de phase et de fréquence pour coder spatialement l’ensemble des spins de la coupe. Les spins, sous l’effet des inhomogénéités de champ vont alors se déphaser jusqu’au temps TE/2 ou une nouvelle impulsion de 180° est appliquée. Cette impulsion va permettre d’inverser les phases de l’ensemble des spins dans le plan transverse. Grâce à cette impulsion les spins vont compenser leur déphasage et ainsi se refocaliser partiellement au temps TE. En s’affranchissant des inhomogénéités de champs par l’intermédiaire de cette impulsion de 180°, on acquiert un signal en pondération T2 et non T2*. Les séquences d’écho de spins permettent d’obtenir des images peu sensibles aux artéfacts. (fig7)
La séquence d’écho de gradient [9,11]
Contrairement à la séquence d’écho de spin, la séquence d’écho de gradient ne dispose pas d’impulsion de 180°, et la première impulsion radiofréquence est en général inférieure à 90°. Cet angle de bascule inférieur à 90° va permettre de diminuer la portion d’aimantation basculée permettant ainsi un retour à l’équilibre plus rapide, et donc un temps de répétition plus court. De fait le principal intérêt de la séquence d’écho de gradient est qu’elle permet l’acquisition d’image plus rapidement que la séquence d’écho de spins. L’absence de pulse de 180° de rephasage des spins rend la séquence sensible aux inhomogénéités du champ, on obtient ainsi des images pondérées en T2*. On obtient l’écho de gradient en appliquant un gradient de lecture bipolaire dans la direction du codage en fréquence. Le premier lobe va accélérer le déphasage de l’aimantation transversale et le second, inversé cette fois, va rephaser partiellement les spins, et permettre une remontée sur courbe de T2*.
5. Construction de l’image
Les images obtenues sont des images en coupe du champ étudié. Celui-ci est divisé en plusieurs plans de coupe, selon l’axe que l’on veut. Chaque plan est lui-même divisé en de nombreux petits cubes, appelés « voxels ». La taille de ceux-ci conditionne la résolution spatiale de l’image. Lors de l’acquisition, un signal est émis à l’intérieur de chaque « voxel ». Celui-ci forme une sinusoïde amortie dans le temps qui est caractérisée par une amplitude, une phase et une fréquence. Une moyenne de ce signal est enregistrée. Elle est caractéristique du tissu présent dans le « voxel ». A partir de cet enregistrement, un codage du signal en plusieurs niveaux de gris est possible.
A chaque « voxel » sera attribuée une nuance de gris. Un signal élevé sera blanc (hypersignal) et un signal faible sera noir (hyposignal).
6. Intensité du champ magnétique
L’amplitude du signal détecté en IRM est proportionnelle à la magnétisation d’équilibre, et la sensibilité du système augmente avec l’intensité du champ magnétique B0 [13]. Actuellement, les systèmes cliniques pour l’imagerie humaine fonctionnent à des intensités variant de 0,2 à 7 Tesla (T), tandis que les systèmes de recherche avancée peuvent atteindre jusqu’à 11,7 T. Les champs élevés utilisés en IRM peuvent exercer des forces extrêmement fortes sur des objets ferromagnétiques, rendant essentiel de prohiber l’introduction d’objets ferromagnétiques dans l’environnement de l’IRM. [13] Une exigence de sécurité clé est de prohiber l’introduction d’objets ferromagnétiques dans l’environnement de l’IRM.
7. La Précession
Toutes les méthodes d’IRM reposent sur la manipulation (à la fois dans l’espace et dans le temps) du vecteur de magnétisation M. Le phénomène fondamental qui permet cette manipulation est la précession de la magnétisation autour du champ magnétique externe principal [13].
La plupart des lecteurs connaissent la précession d’un gyroscope ou d’une toupie. Une toupie qui tourne sur une surface plane tourne autour de son propre axe tout en subissant un couple externe dû à la gravité et à la force de réaction de la surface.
L’interaction entre le moment angulaire et le couple donne lieu à la précession de la toupie autour d’un axe vertical aligné avec la force gravitationnelle.
En IRM, un ensemble de spins dans un volume donné présente un moment angulaire global J qui est proportionnel à la magnétisation nette. L’interaction entre le moment angulaire et le couple appliqué à la magnétisation par le champ externe donne lieu à la précession de la magnétisation autour de l’axe du champ externe.
La fréquence de précession se produit à la fréquence de Larmor f=2/2π B0.
À titre de référence, la fréquence de Larmor d’un proton d’hydrogène dans un champ de 3 T est de 127,7 MHz [13].
CHAPITRE 2. IRM de perfusion
Généralités :
La perfusion par résonance magnétique (IRM) est une technique d’imagerie robuste qui évalue le passage du sang dans le réseau vasculaire cérébral à l’aide de diverses méthodes.
Les applications de la perfusion par IRM se sont considérablement élargies et sont bien adaptées à l’étude d’une variété de maladies cérébrovasculaires ainsi qu’aux processus expansifs intracrâniens.
Cette technique permet de mesurer le degré de la néoangiogenèse tumorale et la perméabilité capillaire (l’intégrité ou la rupture de la barrière hémato- encéphalique du tissu tumoral) qui sont tous deux des marqueurs biologiques importants pour :
- Déterminer la malignité.
- Apprécier le grade.
- Evaluer le pronostic.
- Participer à la prise en charge thérapeutique.
- Apprécier la réponse thérapeutique.
- Guider et orienter les biopsies.
L’évaluation de la perfusion cérébrale complète les informations obtenues par l’IRM conventionnelle et fournit des données supplémentaires sur les caractéristiques biologiques et physiologiques et histologiques des tumeurs cérébrales. [14] Elle permet également d’estimer les variations du volume sanguin dans les tissus sains ou pathologiques.
L’analyse de la microcirculation dans la région explorée peut se faire à l’aide de traceurs exogènes ou endogènes.
Ces derniers modifient le signal provenant des tissus explorés. Nous allons prendre comme exemple l’imagerie de perfusion appliquée à l’encéphale.
L’imagerie de perfusion consiste à modéliser les compartiments biologiques présents dans les tissus.
Ainsi, dans un voxel de substance blanche ou de substance grise, se trouvent trois compartiments :
• le compartiment vasculaire capillaire.
• le compartiment interstitiel ou extracellulaire séparé du précédent par la BHE.
• le compartiment cellulaire séparé du précédent par la membrane cellulaire.
La physiologie tissulaire maintient un équilibre entre chacun de ces trois compartiments.
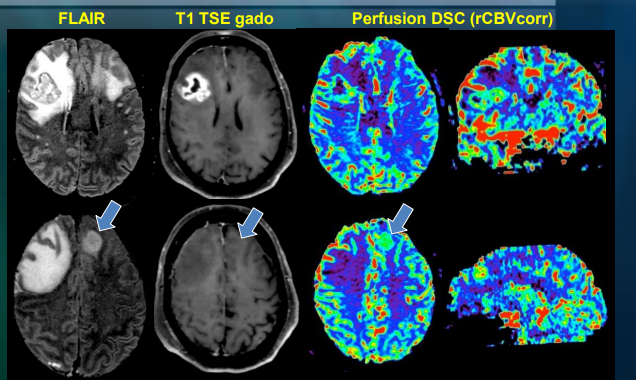
La prise de contraste après injection de gadolinium (Gd) sur les séquences pondérées T1 a longtemps été assimilée à la néovascularisation tumorale. Cependant de récentes études ont montré que cette imagerie classique ne décrit pas uniquement les zones de néoangiogenèse, mais essentiellement des zones de rupture de la barrière hématoencéphalique (BHE) et la présence de vaisseaux hamartomateux. De plus, ces zones tumorales rehaussées ne sont pas toujours représentatives des zones de plus haute malignité de la lésion (histologiquement plus agressive). (fig.8)
2 Imagerie de perfusion avec traceurs exogènes :
2-1 Principe : [15]
La technique adaptée et validée dans l’exploration des tumeurs cérébrales c’est la Dynamic susceptibility contrast (DSC) : Perfusion de premier passage, c’est une imagerie dynamique sensible à l’effet de susceptibilité magnétique induit par le passage en bolus d’un produit paramagnétique.
Elle consiste à utiliser des produits de contraste en guise de traceurs et à étudier la dynamique de ces produits lorsqu’ils passent dans le réseau capillaire (on parle de traceurs exogènes car ils proviennent de l’extérieur de l’organisme). On utilise aussi l’appellation de traceurs « non diffusibles » car ils restent confinés dans le compartiment vasculaire et ne franchissent pas la barrière hémato-encéphalique (BHE) lorsque celle-ci est intacte.
Les agents de contraste principalement utilisés sont ceux à base de gadolinium. Habituellement, le gadolinium est connu pour son action sur les temps de relaxation :
Lorsqu’il est en contact direct avec des molécules d’eau contenues dans des tissus, il raccourcit leurs temps de relaxation T1 et T2, cet effet étant principalement axé sur le T1 à concentration normale.
Mais lorsque le gadolinium est confiné dans la micro vascularisation capillaire, il entraîne une baisse de signal par effet de susceptibilité magnétique : la présence de la substance paramagnétique dans le vaisseau provoque un gradient intrinsèque par rapport aux tissus environnants en raison de sa susceptibilité magnétique plus élevée.
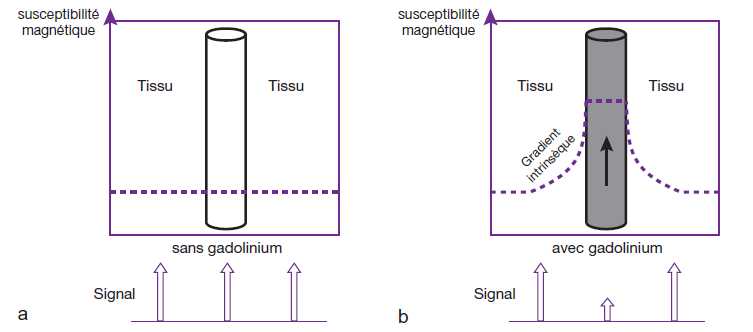
Cela a pour effet d’accélérer les déphasages des spins situés à proximité et donc de raccourcir leur T2 et T2*. La conséquence logique est une diminution du signal au niveau de la zone de tissu concernée sur une distance de quelques millimètres autour du ou des vaisseaux.
- : Avant l’injection de gadolinium, la susceptibilité magnétique est identique dans les vaisseaux sanguins et dans les tissus environnants, et on ne perçoit, par conséquent, aucune modification de signal.
- : Après injection, lorsque le gadolinium est confiné dans la microvascularisation capillaire, il entraîne une baisse de signal par effet de susceptibilité magnétique : la présence de la substance paramagnétique dans le vaisseau provoque un gradient intrinsèque par rapport aux tissus environnants en raison de sa susceptibilité magnétique plus élevée. Cela a pour effet d’accélérer les déphasages des spins situés à proximité, ce qui raccourcit leur T2 et T2*, d’où une diminution du signal au niveau de la zone de tissu concernée sur une distance de quelques millimètres autour du ou des vaisseaux.
2-2 Les séquences ultrarapides de type EPI-EG :
La baisse du signal observée est proportionnelle à la concentration capillaire du produit de contraste.
Pour suivre la modification du signal liée au passage du produit de contraste, il faut répéter l’acquisition des coupes de la région explorée dans un temps très court durant l’injection de l’agent de contraste. [15]
Ces contraintes impliquent l’utilisation d’une séquence ultrarapide de type EPI-EG permettant de « couvrir » l’ensemble de la région (ici le cerveau, soit 20 à 25 coupes) en environ 2 secondes.
Cette séquence est répétée durant l’injection en bolus du produit de contraste d’une dose de 0,2 ml/kg à un débit de 5 à 10 ml/s par voie intraveineuse ( voie d’abord : 18 G ) avec un rinçage par 20 cc de sérum physiologique au même débit , durant environ 60-90 secondes soit une vingtaine de phases . (fig.11-12)

On lance l’acquisition puis on déclenche l’injection. L’acquisition et le post traitement des images nécessitent une console constructrice et un logiciel de traitement. (fig.13)
Le délai très court entre l’acquisition de chaque phase permet d’obtenir une bonne résolution temporelle, et l’injection doit être effectuée à un débit élevé afin d’arriver à une forte concentration de gadolinium dans les vaisseaux.
Le choix d’une séquence de type écho de gradient (EPI-EG) est destiné à améliorer la sensibilité des images au phénomène de susceptibilité magnétique. (fig.14)
Cette procédure permettant de « suivre » le passage du produit de contraste dans une région déterminée est aussi appelée « technique de premier passage ».
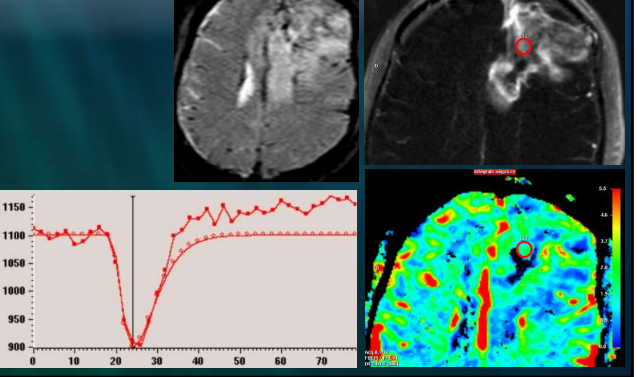
L’ensemble des coupes acquises est ensuite analysé par un logiciel spécifique de post-traitement. Celui-ci permet de calculer la variation d’intensité de signal en fonction du temps par voxel ou sur une zone d’intérêt. [15] Le résultat obtenu peut être visualisé par une courbe sur un graphique dans lequel on a le temps de passage du produit de contraste en abscisse et le pourcentage de perte du signal en ordonnée.
Cette courbe a une forme caractéristique : elle commence par une partie rectiligne (ligne de base) correspondant à une intensité de signal normale, puis s’infléchit vers le bas (arrivée du bolus de gadolinium provoquant la baisse du signal) jusqu’à atteindre un pic (concentration maximale de produit de contraste), puis revient vers la ligne de base. [15] (fig.15)
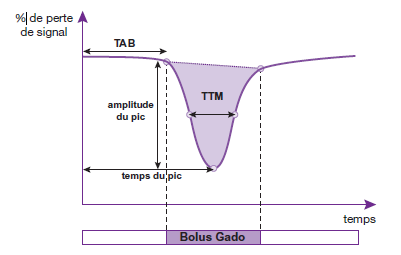
On peut alors calculer un certain nombre de paramètres représentatifs de la perfusion cérébrale de la zone d’intérêt :
- Le temps d’arrivée du bolus (TAB) ou Bolus Arrival Time (BAT) exprimé en secondes.
- Le temps d’arrivée au pic (TTP) ou Time To Peak exprimé en secondes.
- Le temps de transit moyen (TTM) ou Mean Transit Time (MTT) exprimé en secondes.
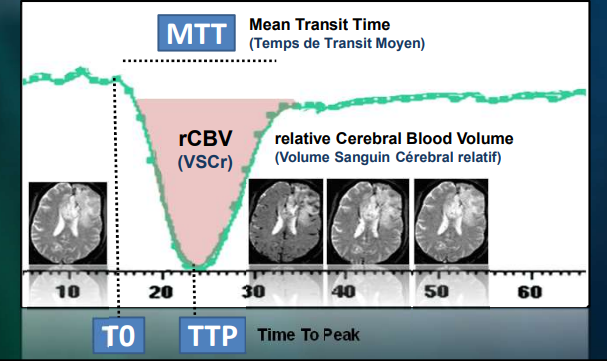
Le rCBV correspond à l’espace rouge au-dessus de la courbe de la perfusion cérébrale. (fig.16)
2-3 Les paramètres de la perfusion cérébrale : [15]
L’imagerie de perfusion est une imagerie pondérée par la circulation dans l’espace intravasculaire. Elle peut évaluer indirectement :
- le volume sanguin régional cérébral (rCBV) ou Regional Cerebral Blood et exprimé en ml/100 g de tissu.
- le temps de transit moyen.
- le débit sanguin régional cérébral ( DSCr) ou Regional Cerebral Blood Flow (rCBF) qui est donné par la relation suivante : CBF=CBV/MTT exprimé en ml/100 g/min.
2.3.1 Le volume sanguin cérébral régionale
Le paramètre utile pour l’exploration des tumeurs cérébrales est le volume sanguin cérébral régional (rCBV). (fig.17)
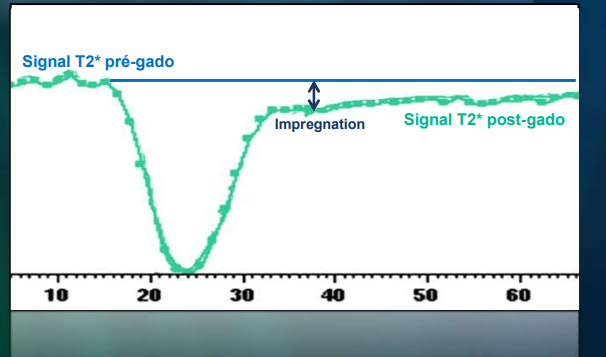
L’imagerie de perfusion consiste à acquérir des images en pondération T2* avec un agent de contraste exogène (Gd) et de visualiser des variations de signal correspondant au premier passage capillaire de cet agent dans les différentes régions.
L’étude de la diminution de signal permet de mettre en évidence une hypoperfusion si la diminution de signal est localement moins importante et une hyperperfusion dans le cas inverse. Si une région ne montre pas de diminution de signal, il s’agit alors d’une absence de perfusion. (fig.18)
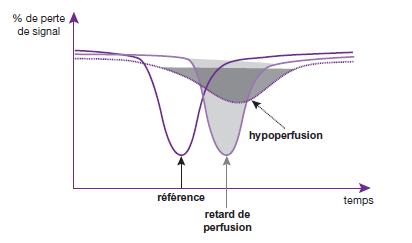
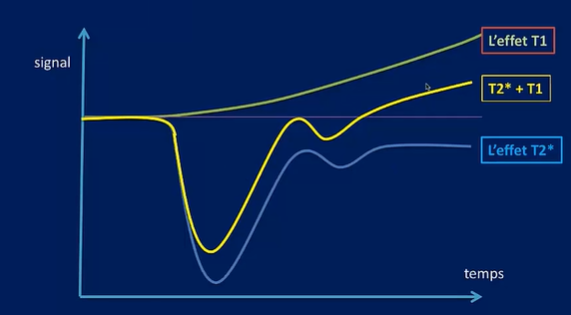
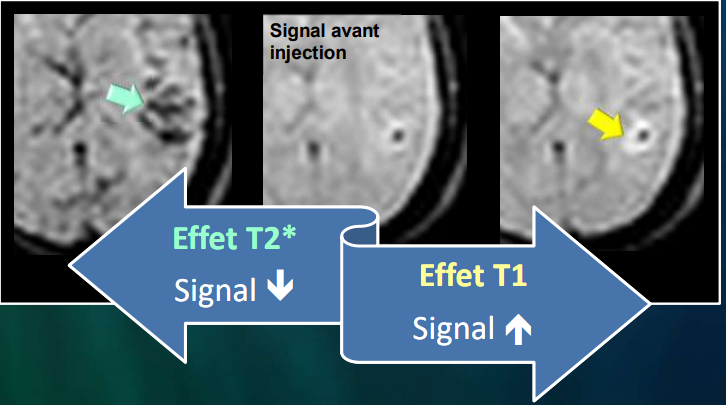
LIRM de perfusion n’a pas seulement une pondération en T2* exclusif, il a aussi une pondération T1.
La pondération T2* va être responsable d’une importante chute du signal puis la reprise du signal qui va arriver à la ligne au-dessous de la ligne de base (courbe bleu).
La pondération en T1 va commencer au début avec un effet prédominant par rapport à l’effet T2* au-dessus de la ligne de base. (Courbe verte)
Donc, l’effet T2* va être responsable d’une chute de signal et l’effet T1 va être responsable d’une augmentation du signal.
La résultante est représentée par une courbe dynamique qui est à la fois la courbe T1 et T2*, à ce niveau il y aura une sous-estimation du rCBV par l’influence de T1 qui était plus important lors de la pondération T2* , et l’effet T1 va être important lors de la rupture de la barrière hémato encéphalique représenté par la courbe au-dessus de la ligne de base suite au passage du PDC au niveau de l’espace extracellulaire . (Courbe jaune) (fig.19)
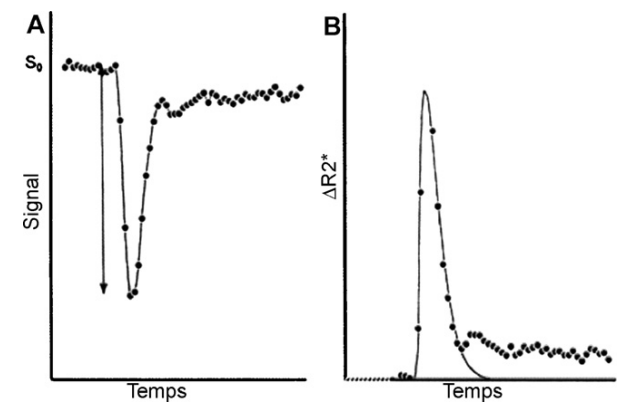
- A : courbe de décroissance du signal en fonction du temps lors du premier passage artériel du produit de contraste.
- B : le rCBV est proportionnel à l’aire sous la courbe de (R2*(t))
Pendant le premier passage du bolus, en fonction de la concentration locale en Gadolinium, les protons subissent un déphasage plus ou moins important responsable d’une diminution du signal.
La variation de ce déphasage (R2*) peut être calculée à partir de la variation de signal.
R2* est proportionnel à la concentration d’agent de contraste situé dans le compartiment vasculaire du volume de tissu exploré et le rCBV est alors proportionnel à la surface sous la courbe de R2*(t), pourvu qu’il n’y ait pas recirculation de produit de contraste.
Or ce phénomène de recirculation existe, il est pris en compte empiriquement par un ajustement des valeurs en fonction du temps avec le logiciel que nous utilisons. (fig.20)
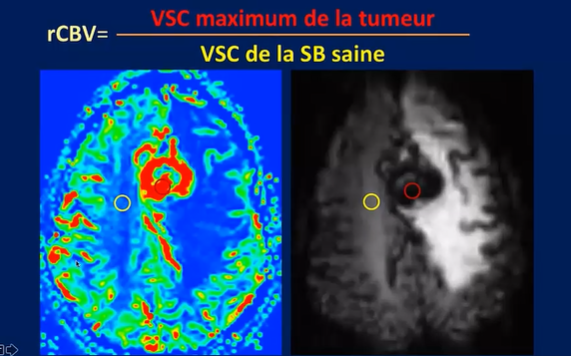
Il est important de souligner que le CBV mesuré n’est pas une valeur absolue, mais une valeur relative par rapport à une mesure réalisée dans un tissu cérébral supposé sain.
Il s’agit donc d’un rCBV calculé en rapportant le volume sanguin maximal de la tumeur au volume sanguin cérébral de la substance saine blanche saine. (fig.21)
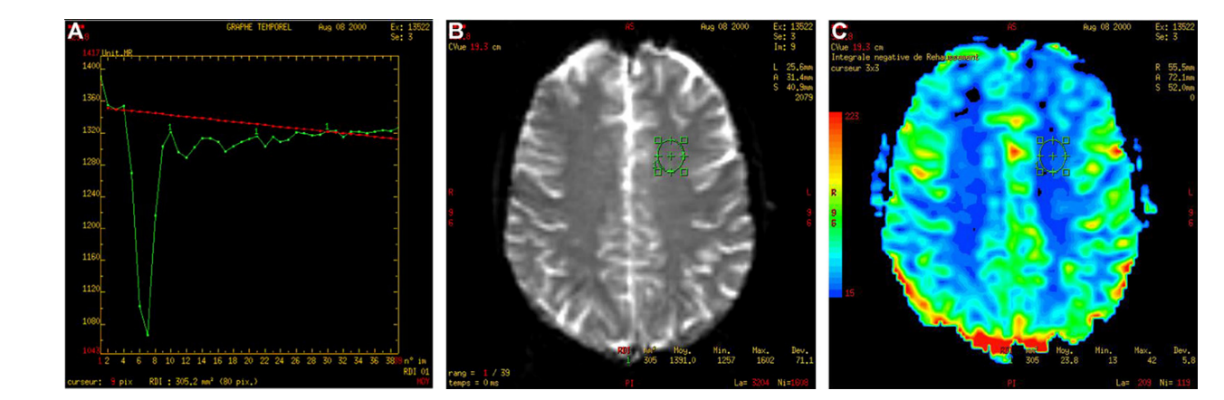
NB : Pour obtenir une mesure quantitative absolue du CBV et du DSC, il faut se disposer de la fonction d’entrée artérielle du produit de contraste (arterial input function). Celle-ci peut être évaluée en mesurant le temps de parcours du traceur (le gadolinium) dans une artère cérébrale destinée (par exemple, la partie terminale de la carotide interne).
A : courbe de décroissance du signal en fonction du temps pour la zone prédéfinie.
B : coupe axiale transverse EPI EG. Calibration à partir d’une zone d’intérêt placée dans la substance blanche supposée saine.
C : cartographie de la rCBV obtenue.
2-3-2Cartographie de rCBV :
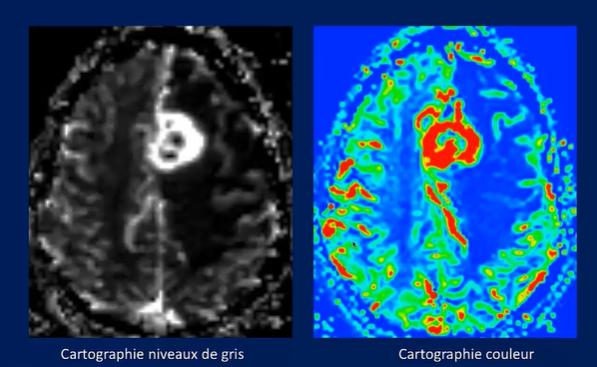
- Cartographie niveaux de gris : la zone hyperperfusé va se traduire en un signe blanc.
- Cartographie couleur :
- La zone hyperperfusé va se traduire en couleur vifs (rouge et orange).
- La zone hypoperfusé va se traduire en couleur bleu.
2-4 Fusion d’image :
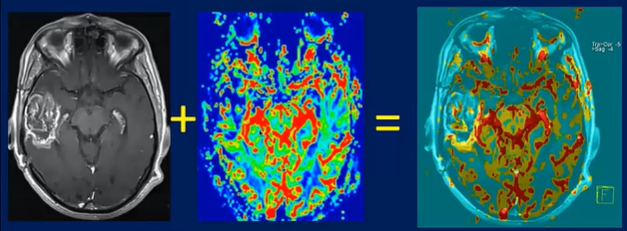
On peut se référer à la technique de fusion d’image entre la cartographie rCBV et l’image T1 après injection de gadolinium afin de savoir chaque prise de contraste correspond à quoi au niveau de le zone perfusée pour établir un diagnostic. (fig.24)
La Figure 24 représente des images d’une tumeur temporale avec importance néoangiogenèse au niveau de la zone postérieure et centrale de la tumeur qui témoigne d’une hyper perfusion de la tumeur sur IRM de perfusion avec prise de contraste au niveau de l’image T1 injectée.
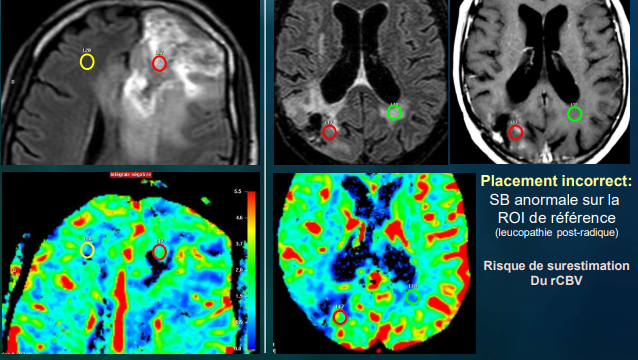
Positionnement des ROI : (fig.25)
Le ROI de référence : substance blanche.
Le ROI en zone pathologique : il faut éviter
- Les zones ou le CBV apparait le plus élevé.
- En dehors de structures vasculaires évidentes ou plexus choroïde.
2-5 Produits de contraste [15]
Comme nous l’avons vu précédemment, le contraste des images d’IRM dépend des paramètres intrinsèques aux tissus (T1, T2, densité protonique), ainsi que des paramètres des séquences (TR, TE, TI) qui permettent de mettre en évidence ces caractéristiques des tissus.
Cette caractérisation tissulaire peut encore être améliorée grâce à l’utilisation des produits de contraste. Ces derniers agissent sur les seuls paramètres modifiables, le T1 et le T2, la densité protonique d’un tissu étant fixe (excepte par ajout de substances dans les organes creux).
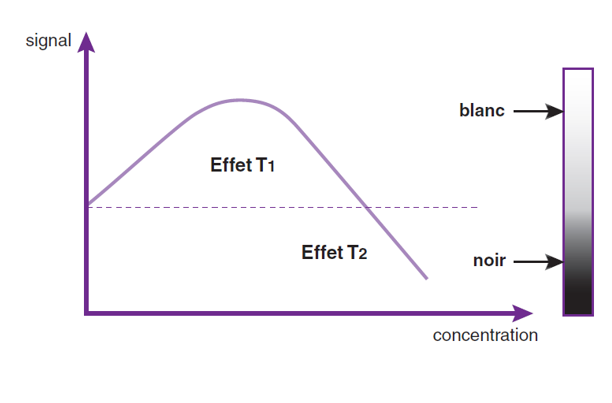
L’action des produits de contraste IRM est donc indirecte : le produit lui-même n’est pas visible (comme l’iode en imagerie par rayons X), mais on détecte son influence sur les temps de relaxation des protons d’eau environnants. Plus précisément, les produits de contraste IRM raccourcissent les temps de relaxation T1 et T2 des tissus, l’un ou l’autre de ces effets étant prédominant en fonction du produit utilise ou de sa concentration. (fig.26)
• Les agents de contraste à effet T1 prédominant : en diminuant le temps de relaxation T1 des tissus, ils conduisent à une augmentation de signal de la structure avec laquelle ils sont en contact, on parle aussi d’agents a contraste «positif».
• Les agents de contraste à effet T2 prédominant : en augmentant la vitesse de décroissance des tissus, ils provoquent une diminution du signal des structures en contact avec ces substances. Ce sont des agents à contraste «négatif».
Les différents produits de contraste IRM se différencient en fonction de leurs propriétés magnétiques, de leur effet sur le signal et de leur répartition dans l’organisme.
En revanche, lorsque la concentration augmente, l’effet T2 devient prédominent ce qui a pour conséquence une diminution du signal (Agent de contraste négatif).
Le gadolinium :
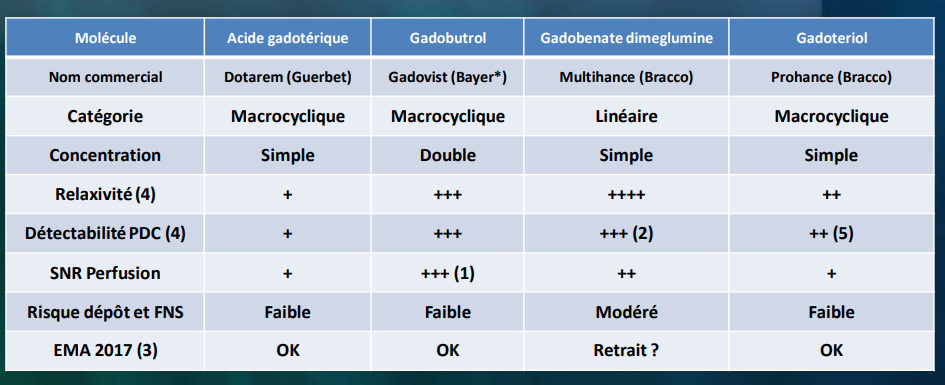
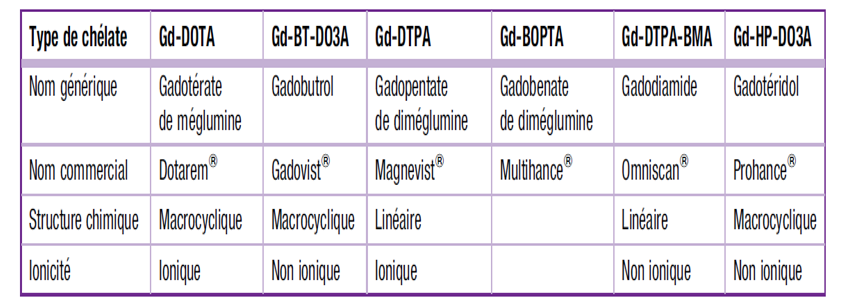
Le gadolinium : métal de la classe des lanthanides ou terres rares, avec ses 7 électrons libres, possède la relativité la plus élevée et présente par conséquent, la meilleure efficacité pour modifier les temps de relaxation. (Tableau 1)
A faible concentration, son effet est principalement T1, entrainant ainsi une augmentation du signal des tissus en contact avec le gadolinium (agent a contraste positif) [14]
En revanche, lorsque la concentration augmente, l’effet T2 devient prédominant, ce qui a pour conséquence une diminution du signal.
Cette modification du signal en fonction de la concentration de gadolinium peut être visible au niveau de la vessie, après injection de l’agent de contraste, conduisant a un aspect caractéristique en trois couches.
Le gadolinium libre (sous forme de sel de gadolinium) étant très toxique, il a fallu masquer cet aspect en l’incorporant a un complexe stable (chélate) tout en maintenant ses propriétés paramagnétiques. Les chélates sont de type linéaire ou macrocyclique.
Les principaux chélates de gadolinium commercialisés en France sont présentés sur le (Tableau 2).
Ces produits sont administrés par voie intraveineuse à une dose usuelle de 0,2 ml/kg de poids corporel.
Leur pharmacocinétique est proche de celle des produits de contraste iodés. Après injection, ils passent rapidement du secteur vasculaire vers l’espace interstitiel. Ils sont ensuite excrétés par le rein par filtration glomérulaire. Au niveau du système nerveux central, ils ne franchissent pas la barrière hématoencéphalique (BHE) saine. En revanche, en cas de pathologie responsable de rupture de la BHE, l’agent de contraste diffuse progressivement dans la lésion, entrainant ainsi un hyper signal de cette dernière sur les images pondérées en T1.
L’utilisation d’une double dose, voire d’une triple dose, de gadolinium permettrait de détecter plus de lésions dans le cadre de la recherche de métastases cérébrales.
Les produits de contraste à base de gadolinium donnent également de bons résultats dans l’étude des pathologies rachidiennes (tumeurs, différenciation entre hernie discale et fibrose postopératoire), thoraciques, cardiaques, abdomino-pelviennes, ostéo-articulaires et mammaires.
Ils peuvent être injectés en bolus, en particulier pour les angio-IRM avec injection de gadolinium ou dans le cas des explorations dynamiques (au niveau du foie, par exemple) permettant de suivre la cinétique de prise de contraste. Ils sont également utilisés dans le cadre de l’IRM de perfusion. Dans ce cas, on se sert plutôt de l’effet de susceptibilité de l’agent de contraste paramagnétique lorsqu’il reste confiner dans le secteur vasculaire et qu’il est injecté en bolus.
Enfin, d’autres traceurs exogènes peuvent être utilisés, en particulier les agents de contraste super paramagnétiques.
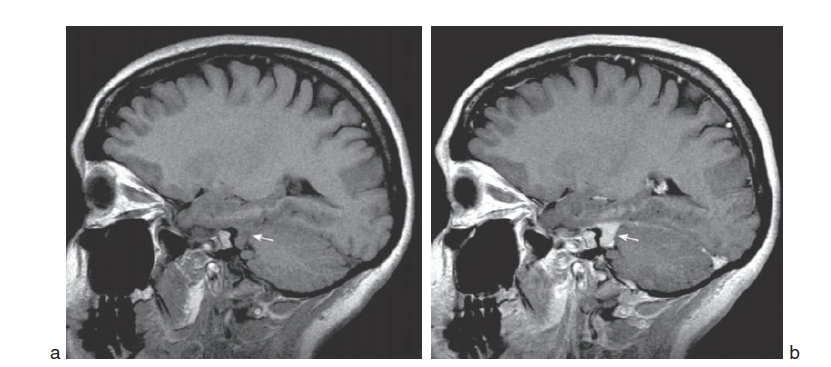
Il s’agit d’un méningiome de l’angle ponto-cérébelleux gauche (flèche), bien mis en évidence après injection de gadolinium (b) par rapport la série réalisée sans injection (a) sur ces coupes sagittales en pondération T1. (fig.28)
Agents paramagnétiques non spécifiques ; [15]
Les propriétés magnétiques d’un corps ou d’une substance sont caractérisées par sa susceptibilité magnétique, c’est-à-dire sa capacité à s’aimanter dans un champ magnétique.
Le paramagnétisme est la conséquence de la présence, au sein d’une substance, d’ions métalliques possédant des électrons non appariés (électrons célibataires). En effet, les électrons, comme les nucléons, possèdent un moment magnétique lié à leur spin (spin électronique).
Le moment magnétique de l’électron est beaucoup plus élevé que celui du proton, en raison d’un rapport charge/masse bien plus favorable. Lorsqu’ils sont appariés, les moments magnétiques de l’électron s’annulent. En revanche, plus l’atome possède un nombre élevé d’électrons célibataires, plus son moment magnétique électronique est grand et plus ses propriétés paramagnétiques sont importantes. Ainsi, les électrons célibataires du corps vont interagir avec les noyaux d’hydrogène situés à proximité : il s’agit d’une interaction entre spin électronique de l’agent de contraste et spin nucléaire du proton entrainant une augmentation de la vitesse de relaxation.
Cette perturbation de l’aimantation des protons à l’origine des modifications des vitesses de relaxation d’un tissu, est caractérisée par la notion de relaxivité : celle-ci détermine l’efficacité d’un agent de contraste en fonction de sa concentration [13].
Imagerie avec traceurs endogènes (ou traceurs diffusibles) [16]
3-1 : Généralités
L’imagerie non invasive de la perfusion tissulaire est un outil précieux pour la recherche et les applications cliniques.
L’étiquetage de spin artériel (ASL) est une méthode d’imagerie de perfusion sans contraste qui permet de mesurer et de quantifier le flux sanguin tissulaire à l’aide de l’imagerie par résonance magnétique.
L’ASL utilise des impulsions de gradient de champ magnétique et de radiofréquence pour marquer l’eau du sang artériel, qui sert ensuite de traceur endogène. L’IRM avec étiquetage par spin artériel (ASL) est une méthode complètement non invasive pour visualiser la perfusion cérébrale.
Les protons d’eau dans le sang sont étiquetés magnétiquement par des impulsions de radiofréquence et, de cette manière, sont utilisés comme traceur endogène au lieu des agents de contraste. Un délai permet au sang étiqueté de se rendre à sa destination, suivi par l’acquisition d’images.
L’ASL a été largement utilisé au cours des 30 dernières années pour l’étude de la fonction cérébrale normale ainsi que dans de multiples pathologies neuro-vasculaires, neuro-oncologiques et dégénératives. L’ASL, qui ne nécessite pas de contraste intraveineux, fait l’objet de recherches et de mises en œuvre cliniques croissantes.
L’ASL n’utilise pas de moyen de contraste injecté, mais les images sont générées à l’aide du sang étiqueté magnétiquement comme agent de contraste endogène. L’ASL peut être réalisée par deux techniques : l’ASL pulsé (pASL) et l’ASL pulsé continu (pCASL). [70]
Dans le pCASL, une onde radiofréquence continue est appliquée pour étiqueter magnétiquement le sang entrant vers le tissu d’intérêt. L’imagerie est ensuite réalisée une fois que l’état d’équilibre est atteint. Cette onde radiofréquence continue offre un excellent contraste de perfusion, cependant, en raison des effets de transfert de magnétisation associés à l’utilisation de l’onde continue, les paramètres de perfusion peuvent être surestimés. [69]
En revanche, le pASL utilise de courtes impulsions de radiofréquence pour étiqueter magnétiquement les protons du sang, le plus souvent au niveau du cou, et ce sang entrant atteint ensuite le tissu d’intérêt. [33]
L’ASL permet une quantification directe des paramètres de perfusion est particulièrement utile chez les patients ayant des contre-indications aux agents de contraste, ainsi que chez les patients pédiatriques et les femmes enceintes. [71]
Cependant, en raison de l’absence d’agent de contraste, la technique a un rapport signal/bruit significativement inférieur à celui des techniques similaires telles que le DSC ou le DCE, ce qui entraîne des temps d’acquisition plus longs et un potentiel accru pour les artefacts de mouvement. [69,70]
Cliniquement, l’utilisation de l’ASL a été plus fréquente dans l’évaluation des maladies neurodégénératives. [72]
Il s’agit, cette fois, de mesurer des différences de signal plus discrètes provenant de la circulation des protons d’hydrogène dans le sang (d’où l’appellation de traceur endogène puisqu’il n’y a pas d’apport extérieur à l’organisme).
Plusieurs méthodes ont été développées et reposent sur le même principe de base : les spins circulants sont « marqués » par l’application d’une impulsion RF associée à un gradient de champ magnétique, avant leur arrivée dans le plan de coupe , ces protons « marqués » se répartissent dans les capillaires sanguins (comme toutes les molécules d’eau) et modifient le signal mesuré dans la coupe en raison des échanges qui se produisent avec les molécules d’eau des tissus stationnaires (a), cette modification de signal est comparée à une image de référence (sans « marquage » des spins) c’est l’image de contrôle (b) et peut alors être corrélée au flux sanguin . (fig.29)
D’une manière générale, la méthode de marquage artériel présente une très faible sensibilité (avec l’avantage d’être non invasive) et fait encore l’objet de nombreuses recherches. (fig.30)
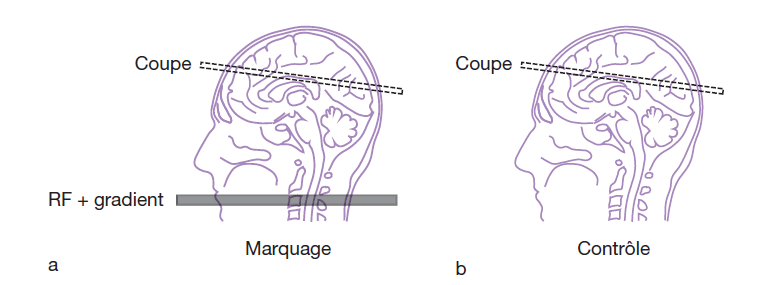
CASL : [16]
Le marquage des spins peut être continu, en appliquant, durant un temps relativement long, une impulsion RF de 180° (inversion) associée à un gradient de champ magnétique. Cette technique est connue sous le nom de CASL (Continuous Arterial Spin Labeling).
PASL : [16]
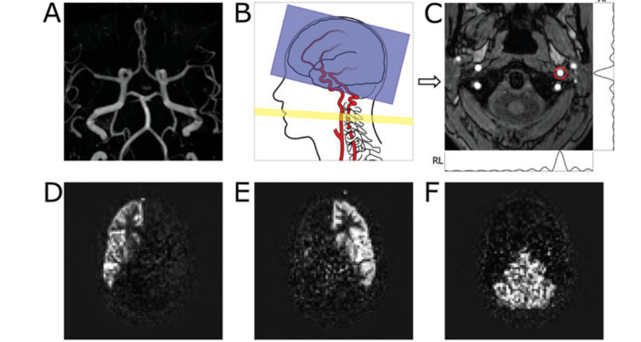
D’autres méthodes sont basées sur un marquage pulsé : PASL (Pulsed Arterial Spin Labeling) comprenant plusieurs évolutions telles que FAIR, EPISTAR, QUIPSS7, etc. Elles permettent de réduire la déposition RF par rapport à la technique CASL et, par conséquent, de réduire le SAR, mais au détriment d’un plus faible rapport S/B.
- La projection maximale d’intensité transversale (A) montre la morphologie d’un cercle de Willis complet.
- Le diagramme schématique (B) représente une coupe sagittale du cerveau et de la vascularisation avec un volume d’imagerie superposé (bleu) aligné parallèlement au plan orbito-méatal. Le plan d’étiquetage (jaune) est prévu perpendiculairement aux deux artères carotides internes (ICA) et aux artères vertébrales. [17]
- L’image d’angiogramme IRM (C) correspond au plan d’étiquetage et montre le point focal super-sélectif (cercle rouge) au-dessus de l’ICA gauche. Les barres sur les côtés droit et inférieur montrent l’efficacité de l’étiquetage dans les directions antéro-postérieure (AP) et droite-gauche (RL) résultant de l’encodage super-sélectif rotatif pour l’ICA gauche. [17]
- Images ASL territoriales de l’ICA droite (D) et de l’ICA gauche (E) ainsi que des artères vertébrales combinées (F).
3-2 : Les avantages de l’ASL sont [82] :
- Sa non-invasivité .
- L’absence de radiations ionisantes.
- L’absence d’injection de produit de contraste.
- Sa sécurité lors de répétitions et sa capacité à fournir des valeurs quantitatives.
Ces avantages rendent l’ASL beaucoup plus adapté aux études de perfusion chez les individus en bonne santé, les suivis répétés, les patients atteints d’insuffisance rénale et les populations pédiatriques.
De plus, l’IRM multiparamétrique de l’ASL associée à d’autres séquences d’IRM non invasives telles que l’imagerie par tenseur de diffusion et la spectroscopie MR protonique, réalisée sur des machines à trois Tesla, a amélioré la performance diagnostique de l’ASL dans l’évaluation des tumeurs cérébrales.
3-3 : Les limites de l’ASL sont :
- Un faible rapport signal/bruit des cartes de TBF (cérébral de flux sanguin) .
- La possibilité d’erreurs systématiques de mesure dues à un retard de transit prolongé entre la région de marquage et la coupe d’imagerie, la dépendance de la relaxation mesurée à l’échange d’eau entre les compartiments intra- et extravasculaires, ainsi que l’élimination de l’eau non extraité par le flux sortant dans le système veineux.
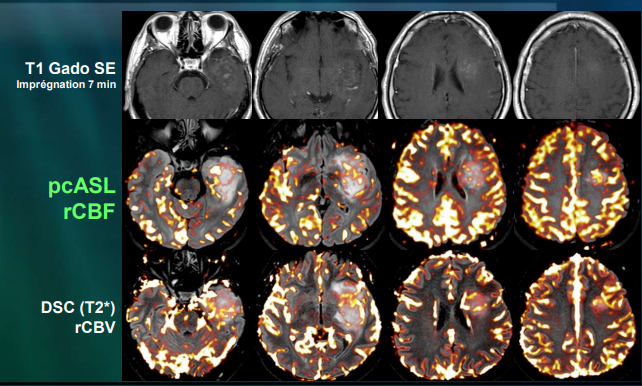
- L’ASL peut être associée à certains artefacts tels que l’artefact de susceptibilité, l’artefact de mouvement, l’effet du produit de contraste à base de gadolinium et l’hyperperfusion paradoxale. Il existe une variation des seuils pour différents paramètres en fonction des techniques utilisées et des machines des différents fabricants. De petites différences dans les paramètres de séquence affectent la reproductibilité de l’ASL, ce qui limite ses applications cliniques et de recherche. Des études supplémentaires pour standardiser les paramètres de l’ASL entre différents fabricants sont recommandées. (fig.31)
4- IRM fonctionnelle [15]
L’IRM fonctionnelle (IRMf) a pour but de visualiser, sur une image d’IRM, les aires cérébrales qui sont activées lors de la réalisation d’une tache : on peut faire appel à des fonctions motrices, sensitives, sensorielles ou cognitives.
4-1 : Principe :
Le principe de l’IRMf repose sur la méthode BOLD (Blood Oxygénation Level Dependent) qui permet de visualiser les variations de perfusion cérébrale. (fig.32)
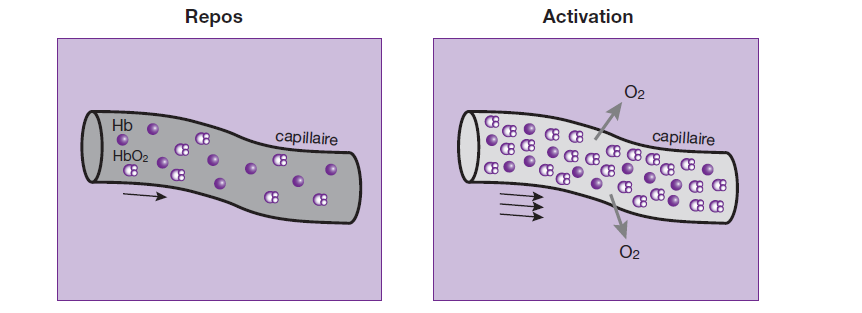
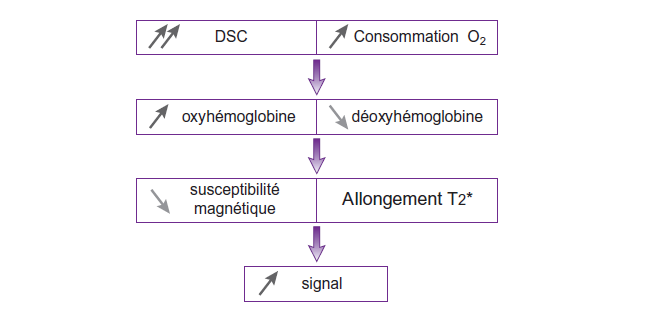
En effet, l’activation cérébrale entraine, localement, à la fois :
• une augmentation conséquente du débit sanguin cérébral.
• une augmentation de la consommation d’oxygène proportionnellement moins importante.
Il en résulte un excès d’oxyhémoglobine (HbO2) dans les capillaires veineux de l’aire activée et, par conséquent, une diminution relative de la concentration en désoxyhémoglobine (Hb).
La désoxyhémoglobine est paramagnétique et possède donc une susceptibilité magnétique plus élevée que l’oxyhémoglobine (qui est diamagnétique).
En effet, la désoxyhémoglobine, produit de désoxygénation de l’hémoglobine, possède quatre électrons du fer non appariés (liés à l’oxygène dans l’oxyhémoglobine), ce qui induit son caractère paramagnétique et provoque, habituellement, une baisse de signal par effet de susceptibilité magnétique.
Ainsi, la baisse de concentration de désoxyhémoglobine va entrainer une faible augmentation du signal dans le territoire actif sur les séquences pondérées en T2* (par allongement du T2* du sang dans les capillaires).
Le rehaussement de signal obtenu dans les zones activées est très faible (environ 2 à 5 %), ce qui implique une multiplication des mesures à effectuer.
Le «contraste BOLD» augmente avec l’intensité du champ magnétique B0 en raison d’une meilleure perception des différences de susceptibilité magnétique lorsque B0 est plus élevé.
Habituellement, ces explorations nécessitent un imageur d’au moins 1,5 Tesla. Les séquences mises en œuvre sont de type écho de gradient (afin d’obtenir une pondération en T2*) plus sensibles aux phénomènes de susceptibilité magnétique : il s’agit, en général, de séquences EPI qui permettent de couvrir tout le cerveau avec une bonne résolution temporelle et en réduisant le risque d’artefacts de mouvements.
L’activation cérébrale entraine, localement, une augmentation conséquente du débit sanguin cérébral et une augmentation de la consommation d’oxygène, mais qui est proportionnellement moins importante. Il en résulte un excès d’oxyhémoglobine (HbO2) dans les capillaires veineux de l’aire activée et, par conséquent, une diminution relative de la concentration en désoxyhémoglobine (Hb). Cette dernière est paramagnétique et possède donc une susceptibilité magnétique plus élevée que l’oxyhémoglobine. Sa baisse de concentration entraine, ainsi, une faible augmentation du signal dans le territoire activé sur les séquences pondérées en T2* (par allongement du T2* du sang dans les capillaires) (Tableau 3)
4-2 Déroulement d’un examen d’IRM fonctionnelle [15]
La réalisation d’une exploration d’IRM fonctionnelle comprend, habituellement, une alternance de périodes de repos et de périodes d’activation durant lesquelles le sujet réalise une tâche ou reçoit une stimulation.
Ce cycle en forme de « blocs » (on/off), alternant activation et repos, est appelé un paradigme. Par exemple, dans le cas d’une activation motrice (mouvements d’opposition du pouce et des doigts de la main), cette tâche sera effectuée pendant une durée de 30 secondes suivie d’un repos de 30 secondes, puis de nouveau effectuée durant 30 secondes, etc.
Une acquisition, généralement de type EPI-EG sera effectuée durant l’ensemble du paradigme (activation et repos).
Les séquences EPI-EG sont plus sensibles aux effets de susceptibilité magnétique que les échos de spin, mais sont utilisées en raison de leur capacité à couvrir de grandes zones du cerveau avec une bonne résolution temporelle.
Comme les modifications de signal dues à l’effet BOLD sont très faibles, cette multiplication des mesures est indispensable, ce qui implique l’acquisition d’un très grand nombre d’images.
Le traitement des données consiste à établir une corrélation, voxel par voxel, entre les images acquises durant les périodes d’activation et de repos, ainsi que la réponse hémodynamique obtenue, se manifestent par une augmentation de signal due à l’effet BOLD.
Un post-traitement permet d’éliminer les zones d’activation dues à des vaisseaux de gros calibre (pourcentage d’activation supérieur à 5 %) et ainsi de retenir uniquement l’activation correspondant à la microcirculation.
Les résultats sont ensuite présentés sous forme de cartes statistiques qui sont superposées à une image anatomique à haute résolution, réalisée au préalable. Les acquisitions réalisées en IRMf nécessitent un certain nombre de précautions. Ainsi, concernant les séquences utilisées, le choix du temps d’écho est déterminant pour améliorer la sensibilité du contraste BOLD. (fig.33)
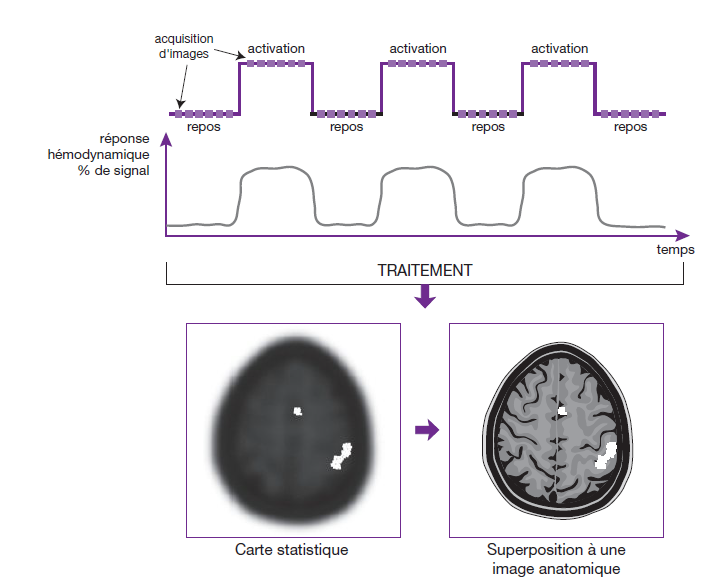
En technique EPI-EG, il doit se situer aux alentours du T2* des tissus environnants. En effet, l’effet de susceptibilité magnétique augmente avec le TE, mais au détriment du rapport signal sur bruit.
4-3 : Applications de l’IRMf [15]
Rappelons que l’IRMf ne permet pas de mesurer directement l’activité neuronale, mais elle met en évidence les variations de flux sanguin liées à cette activité. Elle est encore essentiellement un outil de recherche, mais certaines applications peuvent actuellement s’effectuer en routine clinique.
L’IRMf est déjà utilisée pour le repérage pré chirurgical des aires fonctionnelles motrices et sensitives, ainsi que des aires du langage, dans le cadre de résections de tumeurs. Les activations motrices, par exemple, peuvent être réalisées facilement sans matériel particulier. En effet, les appareils d’IRM actuels disposent généralement des séquences et des logiciels de base nécessaires pour effectuer cette opération. De la même manière, cette technique est utilisée dans le cadre de l’épilepsie et semble être une alternative fiable au test de Wada.
Pour l’étude du cortex visuel ou auditif, il faut disposer de matériel adapté ainsi que de logiciels permettant la synchronisation entre les paradigmes et l’acquisition des séquences. Pour les stimulations visuelles, on peut utiliser un miroir fixe sur l’antenne ou des lunettes spéciales permettant la transmission des images.
Les stimulations auditives sont transmises par l’intermédiaire d’écouteurs (ou d’un casque) disponibles, en général, sur tous les appareils.
Dans le domaine de la recherche, l’IRMf est également utilisée en psychiatrie ainsi que pour l’étude des fonctions cognitives, en particulier celles touchant la mémoire.
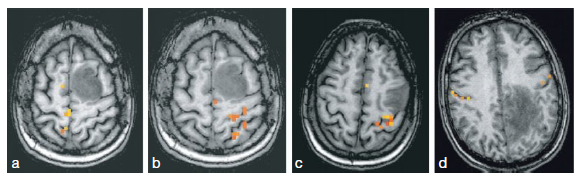
- L’aire motrice du pied (a) est proche du vertex et de la ligne médiane.
- Celle de l’épaule est sous-jacente (b).
- L’aire motrice de la main est située dans un « oméga » renversé du sillon central (c).
- L’aire motrice de la face est, bien sûr, bilatérale (d).
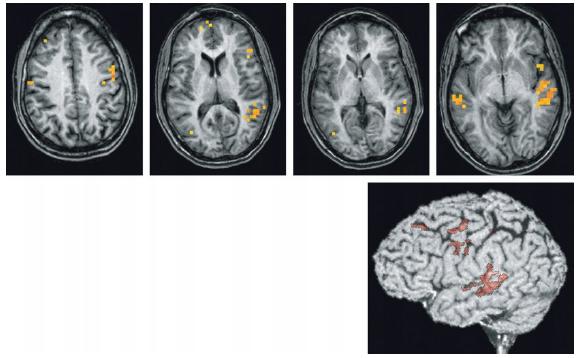
- Ces études permettent de visualiser la latéralisation du langage, ici au niveau de l’hémisphère gauche chez un droitier.
- La complexité du langage nécessite plusieurs paradigmes comme la répétition de mots, l’écoute d’histoires, et la reconnaissance d’objets pour distinguer l’aire de Broca (en haut) et l’aire de Wernicke (en bas).
- Cette dernière étant bien mise en évidence sur cette série d’images.
5-Protocole de l’IRM pour l’étude des tumeurs cérébrales : [18]
Imagerie par résonance magnétique structurelle (IRM) conventionnelle reste la méthode d’imagerie standard pour la pratique neuro-oncologique. Les recommandations consensuelles actuelles pour un protocole d’IRM standardisé des tumeurs cérébrales sont les suivantes :
- T1 tridimensionnel (3D).
- Inversion axiale atténuée par fluide (FLAIR).
- Imagerie axiale pondérée en diffusion (DWI).
- T2 axiale avec contraste au gadolinium et T1 3D avec contraste au gadolinium.
- Les séquences doivent être réalisées sur un système d’IRM d’au moins 1,5 tesla.
Si les séquences 3D ne peuvent pas être réalisées en raison de contraintes de temps ou de limitations techniques, des séquences 2D peuvent être utilisées.
Les séquences structurelles (pondérées en T2, FLAIR et pondérées en T1 avant et après contraste) constituent la base principale d’un examen IRM.
Des séquences pré-chirurgicales spécifiques telles que l’imagerie par écho de gradient altéré en 3D iso-volumétrique à haute résolution pondérée en T2 et l’imagerie par écho de gradient altéré en 3D T1 post-contraste peuvent être obtenues avec des marqueurs de référence pour la navigation peropératoire ou avec un cadre de tête pour la planification radio chirurgicale stéréotaxique.
CHAPITRE 3. Applications cliniques de l’IRM de perfusion dans la pathologie tumorale cérébrale. [18]
L’IRM est le pilier de la neuroimagerie moderne, ayant comme objectif la détection la plus précoce du processus tumoral, la précision de la topographie de la lésion et établir la corrélation entre le tableau clinique et les données de l’imagerie, de définir la nature de la lésion et donner des renseignements topographiques, morphologiques, métaboliques et fonctionnelles, contribuant ainsi à la décision thérapeutique et la surveillance du processus tumoral.
Bien que l’identification d’un type de tumeur histologique précis puisse être difficile sur la base de l’imagerie seule, le diagnostic correct peut souvent être suggéré selon plusieurs considérations, en particulier lorsque les caractéristiques d’imagerie sont prises en compte dans le contexte de l’âge du patient, de la durée des symptômes, de la présence d’une tumeur maligne primaire extra crânienne et des antécédents de radiothérapie cérébrale.
L’IRM offre un contraste des tissus mous supérieur aux autres techniques d’imagerie transversale, ce qui permet une meilleure visualisation de l’architecture parenchymateuse subtilement infiltrée ou perturbée.
De plus, les agents de contraste à base de gadolinium par voie intraveineuse raccourcissent les temps de relaxation T1 et augmentent le contraste tissulaire en accentuant les zones où les agents de contraste ont fui hors de la barrière hémato-encéphalique (BHE) vers les tissus interstitiels, ce qui entraîne un rehaussement parenchymateux.
Cette rupture de la BHE est une caractéristique clé observée dans les tumeurs ainsi que dans les affections non néoplasiques. L’emplacement de la lésion primaire peut aider à différencier les types de tumeurs.
Par exemple, les tumeurs extra-axiales telles que les méningiomes, les schwannomes et les tumeurs de la base du crâne peuvent généralement, mais pas toujours, être différenciées des tumeurs intra-axiales en fonction de l’interposition associée de liquide céphalorachidien, des vaisseaux ou de dure-mère entre la masse et le cortex.
De même, le nombre de lésions est une considération importante car des lésions multiples suggèrent une maladie métastatique ou des processus non néoplasiques tels que la démyélinisation, l’inflammation ou l’infection. Enfin, plusieurs caractéristiques d’imagerie suggèrent des sous-types de tumeurs.
La combinaison d’un kyste et d’un nodule solide au sein d’une tumeur suggère des tumeurs cérébrales telles que le gangliogliome, l’astrocytome pilocytique, le xanthoastrocytome pléomorphe et, dans la fosse cérébrale postérieure l’hémangioblastome.
Des calcifications peuvent être observées dans les oligodendrogliomes, les épendymomes et les tumeurs pinéales, entre autres.
Une nécrose et une hémorragie sont observées dans les gliomes de grade élevé, certaines métastases et, plus rarement, dans les lymphomes du système nerveux central (SNC) chez les patients immunodéprimés.
1 – Pathologie tumorale :
Il existe deux groupes de tumeurs cérébrales, les tumeurs de localisation intra-axiales qui sont le plus souvent de nature maligne comprennent les métastases et les tumeurs cérébrales primitives et le groupe extra-axiales qui sont souvent de nature bénigne. L’objectif de l’’imagerie par IRM, la détection la plus précoce du processus tumoral, de préciser la topographie de la lésion et établir la corrélation entre le tableau clinique et les données de l’imagerie, de définir la nature de la lésion et donner des renseignements topographiques, morphologiques, métaboliques et fonctionnelles, contribuant ainsi à la décision thérapeutique et la surveillance du processus tumoral. L’imagerie de perfusion permet la précision de la localisation de la tumeur et aide à la confirmation du processus tumoral.
L’exploration IRM d’un processus tumoral doit inclure au minimum des coupes sagittales en T1 et/ou coronales et axiales, des coupes axiales en densité protonique, en FLAIR et en T2 et trois plans de coupes en T1 après injection de contraste.
L’adjonction de coupes en imagerie de diffusion est systématique en cas de processus tumoral intra-axial, car elle apporte, d’une part, des informations sur la cellularité tumorale informant sur la malignité des tumeurs gliales et des lymphomes cérébraux primitifs et aussi pour le diagnostic différentiel entre tumeur et ischémie ou entre tumeur nécrosée et abcès en cas de prise de contraste annulaire [27 ,28].
Les techniques d’IRM de perfusion offrent une évaluation quantitative plus précise des paramètres physiopathologiques, permettant une classification plus fine des tumeurs intracrâniennes et une meilleure différenciation entre les tumeurs et les tissus normaux.
En effet, les temps de relaxation T1 et T2, bien qu’ils soient liés à l’angiogenèse tumorale et à l’intégrité de la barrière hémato-encéphalique, ne sont que modérément spécifiques à la malignité.
Lorsque les lésions intracrâniennes se sont développées à partir du parenchyme cérébral, on parle de lésions intra-axiales mais, lorsque les pathologies intracrâniennes se forment à partir des méninges ou des nerfs crâniens, on parle de lésions extra-axiales.
Tumeurs intra-axiales
Les tumeurs intra axiales sont dominées par les tumeurs gliales. L’imagerie oriente vers le grade de malignité du gliome, on se basant sur la présence ou l’absence d’une prise de contraste, à l’opposé des tumeurs sans prise de contraste évidente peuvent être de grade élevé. A la découverte de tout processus tumoral intracérébral une imagerie de diffusion s’impose devant une lésion expansive à prise de contraste annulaire. [19]
L’IRM multimodale associant les séquences conventionnelles (T2* écho de gradient, T2, T1, diffusion, T1 après injection de gadolinium).
L’imagerie par IRM conventionnelle fournit des informations anatomiques importantes ; cependant, elle est insuffisante pour déterminer le grade des tumeurs avant l’opération. Le rehaussement au contraste sur l’imagerie IRM montre des zones de rupture de la barrière hémato-encéphalique, souvent associées à un grade tumorale plus élevé. Cependant, le rehaussement au contraste n’est pas toujours précis pour prédire le grade de la tumeur. Même dans les gliomes de haut grade avec un rehaussement pathologique au contraste, celui-ci ne reflète pas toujours les zones de néovascularisation et d’angiogenèse.
L’IRM de perfusion et la spectroscopie oriente le diagnostic de nature et évalue le grade de malignité d’un processus tumoral intracrânien central en fournissant des images anatomiques détaillées. Cependant, sa capacité à caractériser le grade et le potentiel malin des tumeurs s’avère limitée. [19]
L’IRM fonctionnelle est utile pour le repérage préopératoire des zones fonctionnelles motrices, visuelles et du langage. [19]
Tumeurs gliales :
Les gliomes sont les néoplasmes cérébraux primaires les plus courants chez les adultes, sont des tumeurs très hétérogènes. On distingue les tumeurs gliales de bas grade et de haut grade. Les gliomes de haut grade peuvent être des tumeurs extrêmement invasives et très vasculaires. [83] Ces tumeurs se localisent au niveau d’un ou plusieurs lobes cérébraux. L’incidence des glioblastomes est de 4 cas pour 100 000 habitants par an. L’incidence des gliomes malins est en augmentation, en relation avec les facteurs environnementaux. [28, 29, 30].
Le classement des gliomes est actuellement basé sur l’évaluation histopathologique de la tumeur, obtenue par la biopsie stéréotaxique du cerveau ou chirurgie cytoréductive. Cependant, ces techniques et leur interprétation présentent des limitations inhérentes.
Les approches thérapeutiques, la réponse au traitement et le pronostic dépendent d’un classement précis, et il est donc crucial de trouver la partie de la tumeur ayant le grade le plus élevé pour la biopsie. [84-85]
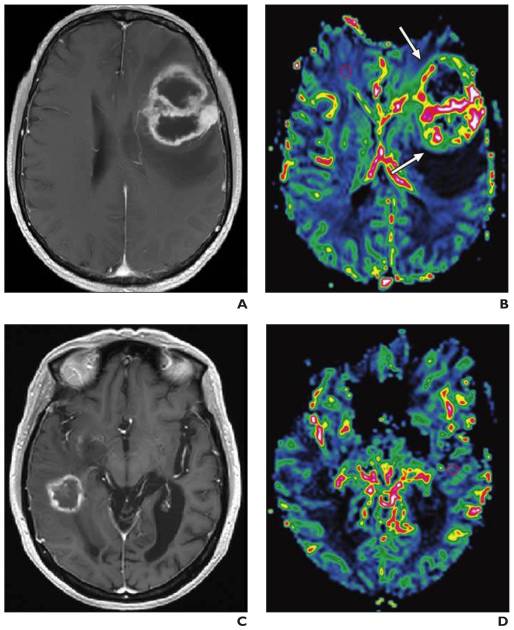
Étant donné que l’angiogenèse est une caractéristique importante des gliomes malins, l’imagerie de perfusion peut fournir des informations supplémentaires importantes. Un principe général de l’imagerie oncologique de perfusion est qu’avec la croissance tumorale, les besoins métaboliques augmentent en raison de la croissance cellulaire rapide et du renouvellement cellulaire. L’hypoglycémie cellulaire et l’hypoxie entraînent la production de cytokines angiogéniques, ce qui entraîne la néoangiogenèse, augmentant à son tour l’atténuation capillaire au sein de la tumeur. L’augmentation de l’atténuation capillaire conduit à un volume sanguin et un débit sanguin plus élevés dans le lit tumoral. [86-87] (fig.36)
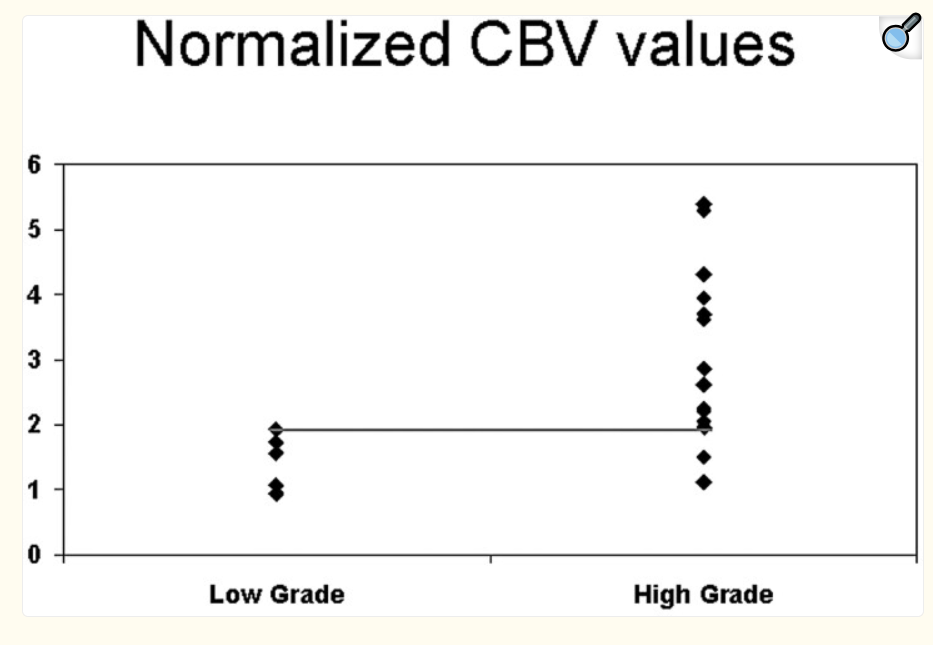
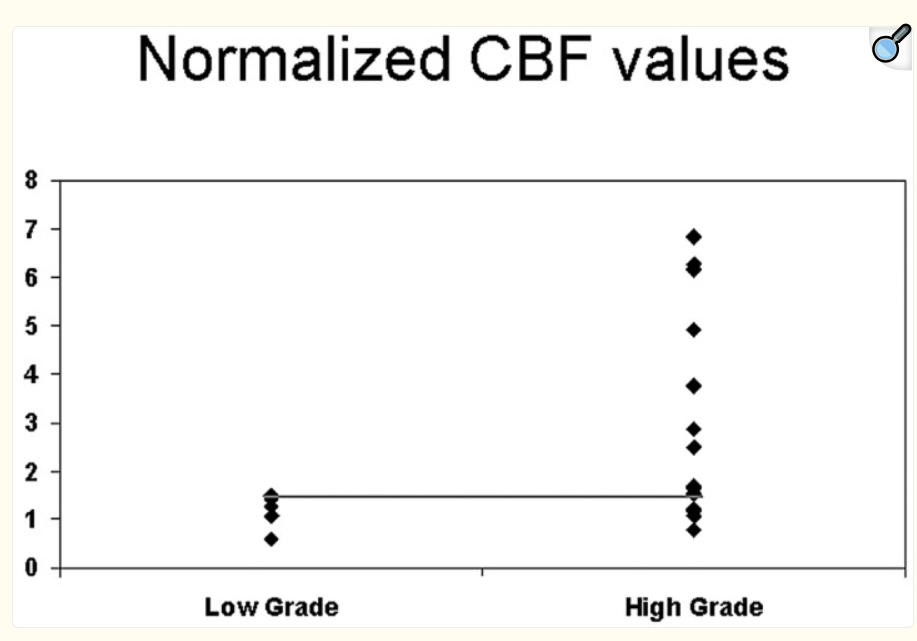
L’imagerie par résonance magnétique (IRM) conventionnelle joue un rôle limité dans la différenciation des gliomes, car les images avec produit de contraste révèlent une barrière hémato-encéphalique perturbée ou absente, sans nécessairement indiquer la microvascularité ou la néovascularisation de la lésion tumorale , le rCBV a été évaluée plusieurs fois dans des études de perfusion par IRM, qui ont montré que les ratios moyens de rCBV pour les gliomes de haut grade allaient de 3,64 à 7,32, ce qui diffère de manière significative de ceux des gliomes de bas grade, qui vont de 1,11 à 2,14.[88-89]
Les deux facteurs les plus importants pour déterminer la malignité des gliomes sont leur capacité à infiltrer le parenchyme cérébral et à recruter ou synthétiser des réseaux vasculaires pour leur croissance. [90-91]
L’imagerie de perfusion des tumeurs cérébrales est utile pour aussi distinguer une tumeur récurrente de la nécrose due à la radiothérapie.
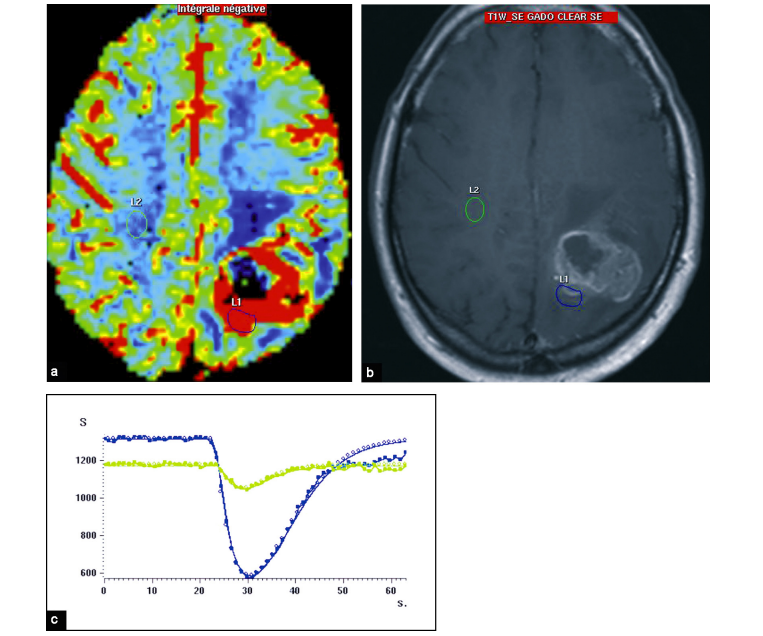
a : L’hypervascularisation est visible sur la cartographie du volume sanguin cérébral (VSC):
b : Cette hypervascularisation s’étend au-delà de la prise de contraste
c : Le ratio de VSC entre la zone tumorale et la zone saine est très élevé, atteignant 9,2.
Gliomes de bas grade : L’IRM objective une lésion qui élargit les circonvolutions cérébrales et apparaît hypointense en T1, hyperintense en densité protonique en T2 et en FLAIR ne se rehausse pas après injection de contraste.
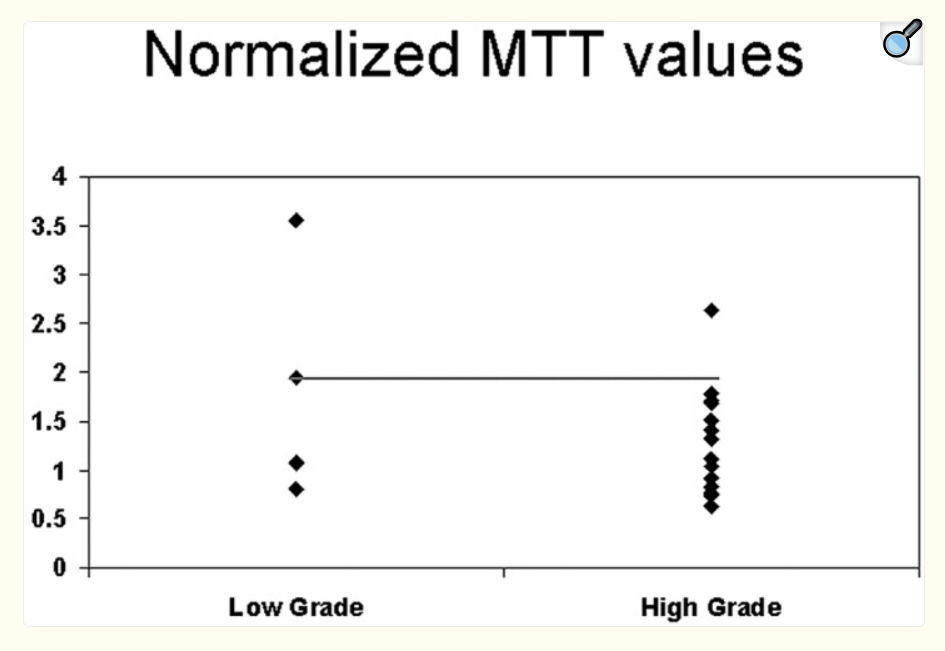
L’IRM de perfusion joue un rôle important car il existe une forte corrélation entre le grade du gliome et le rCBV obtenu à partir de l’IRM DSC de perfusion [31, 32 – 33]. La constante de transfert (K trans) semble également être corrélée au grade du gliome, cependant, la corrélation entre le rCBV et le grade semble plus forte [19] (fig.37-38)
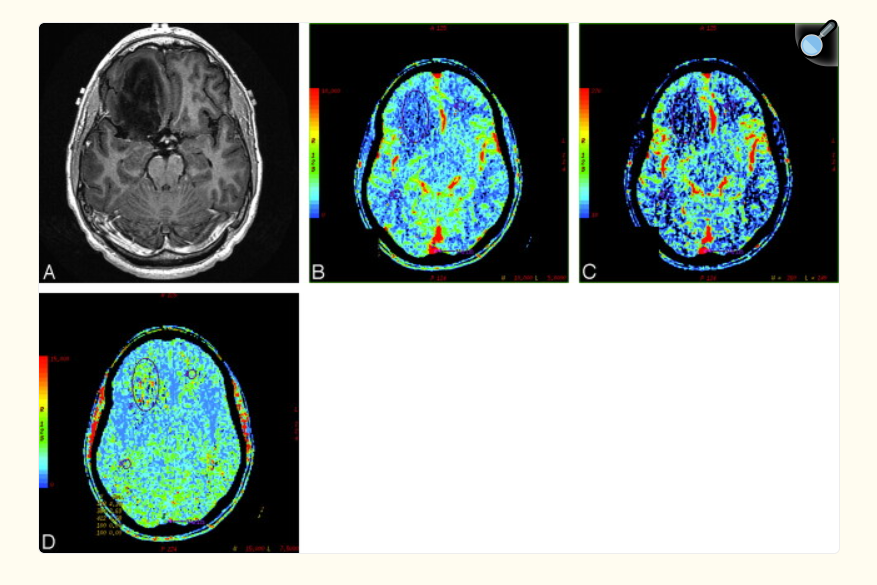
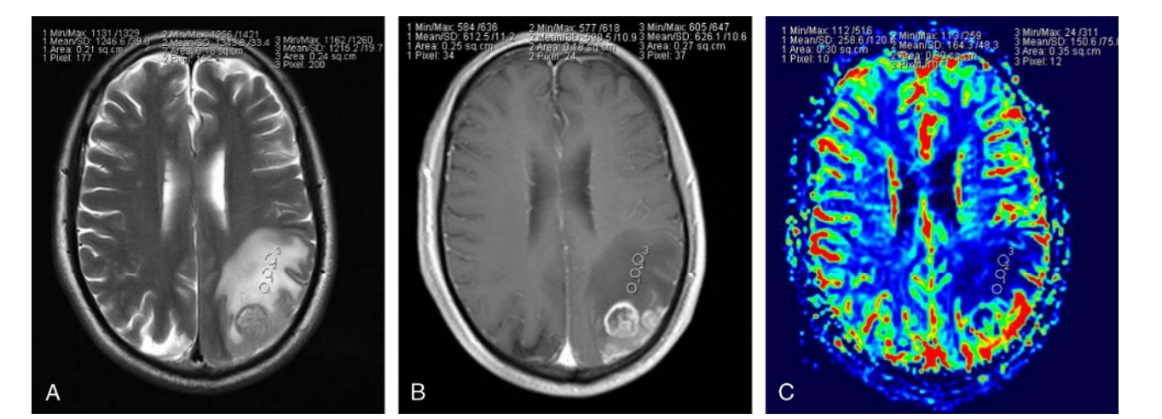
A, Image axiale en T1 après injection de produit de contraste montrant une masse non rehaussée dans le lobe frontal droit.
B, Carte de volume sanguin cérébral (CBV) montrant un faible volume sanguin (rCBV = 0,94).
C, Carte de débit sanguin cérébral (CBF) montrant un débit sanguin réduit (rCBF = 1,26).
D, Carte de temps de transit moyen (MTT) montrant un temps de transit prolongé (rMTT = 1,07) au sein de la tumeur.
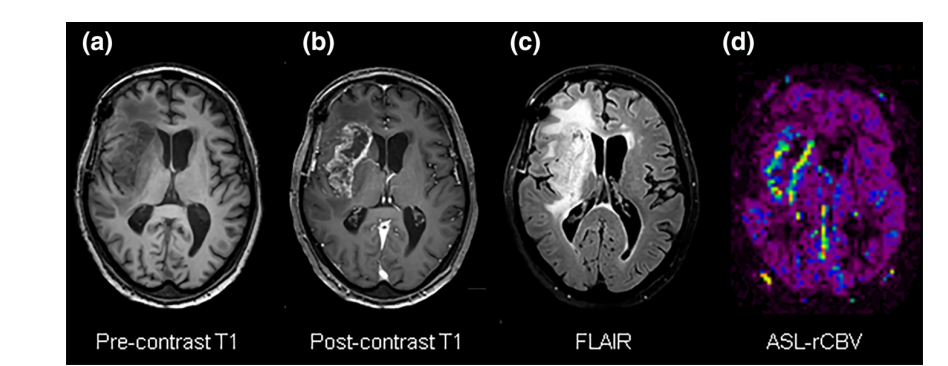
- Les images T1 pondérées avant (a) et après contraste (b) et les images FLAIR (c) ont montré une augmentation significative de la lésion.
- L’imagerie de perfusion ASL (d) était en accord avec les images anatomiques, démontrant des valeurs de rCBV augmentées (jaune) correspondant à la progression tumorale.
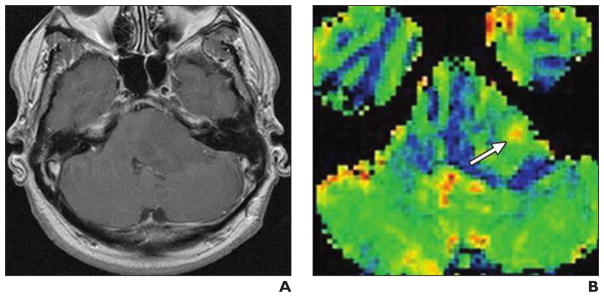
A. L’image d’écho de spin pondérée en T1 avec injection de produit de contraste ne montre aucune prise de contraste.
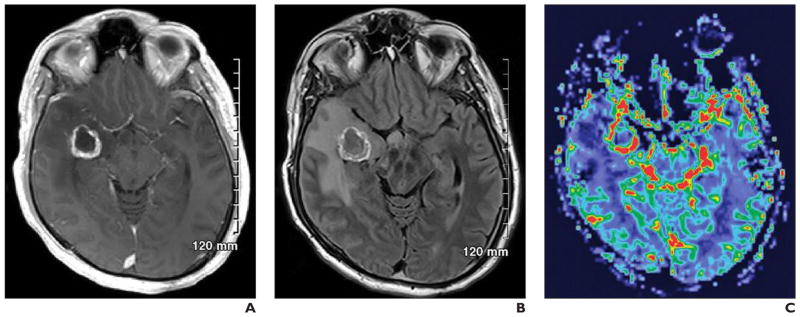
B. L’IRM de perfusion avec contraste de susceptibilité dynamique (0,1 mmol de gadobutrol injecté à 5 ml/s avec 20 ml de solution saline) montre une hyperperfusion focale au centre de la tumeur suspecte d’être une lésion de grade supérieur (flèche).
La transformation anaplasique de la tumeur a été confirmée par une biopsie ciblée.
Gliomes de haut grade: Les gliomes sont histologiquement très hétérogènes, avec des degrés variables de pléomorphisme cellulaire et nucléaire, d’activité mitotique, de prolifération vasculaire et de nécrose. S’observe principalement entre 55 et 85 ans. [34, 35, 36,37]
L’IRM montre une lésion de signal hétérogène en relation avec la présence de foyers nécrotiques et de formations kystiques, aux contours souvent irréguliers, de signal hypointense en T1, hyperintense en T2 en densité protonique et en FLAIR, avec la présence d’un œdème et un effet de masse. [34,35].
En T2, l’hyperintensité de la tumeur est variable, l’œdème présente un signal hyperintense intermédiaire. La cartographie du T2 qui correspond au T2* permet de refléter l’influence de la déoxyhémoglobine et la consommation d’oxygène, le signal est plus bas dans les tumeurs qui présentent les grades de malignité les plus élevés à cause de l’augmentation du métabolisme et de la consommation d’oxygène [38,39].
Le degré de prolifération vasculaire est l’un des éléments les plus critiques dans la détermination du grade de la tumeur et du pronostic. Ainsi, l’évaluation non invasive de la vascularité des gliomes avant l’opération peut être utile pour déterminer le potentiel malin de la tumeur, pour sélectionner un site de biopsie approprié, pour prédire la transition d’un gliome de bas grade vers un gliome de haut grade et également pour surveiller la réponse aux différents traitements. [88] (fig.40)
On note des problèmes de diagnostics différentiels, entre tumeur gliale de grade élevé ou lymphome cérébral primitif et des formes pseudotumorales de pathologies démyélinisantes.
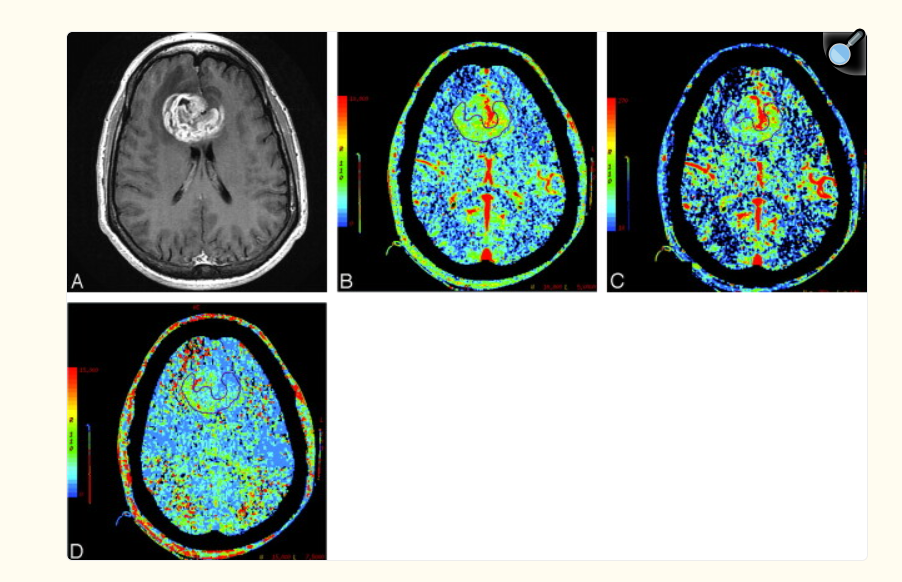
A, Image axiale en T1 après injection de produit de contraste, montrant une tumeur nécrotique bi frontale fortement rehaussée, avec atteinte du genou du corps calleux et un œdème de la matière blanche péri lésionnelle environnante.
B, Carte de volume sanguin cérébral (CBV) montrant un volume sanguin élevé (nCBV = 4,3).
C, Carte de débit sanguin cérébral (CBF) montrant un débit sanguin élevé (nCBF = 6,27).
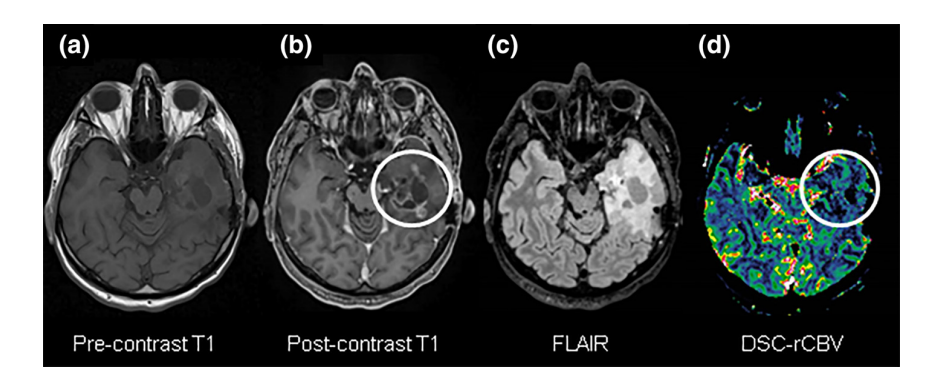
Les images T1 pondérées avant (a) et après contraste (b) et les images FLAIR (c) étaient toutes deux suggestives d’une maladie progressive apparente. Cependant, le DSC (d) a correctement montré que ces changements étaient dus à une pseudoprogression , les valeurs de rCBV n’étaient pas élevées au niveau de la lésion en rehaussement (cercles blancs).
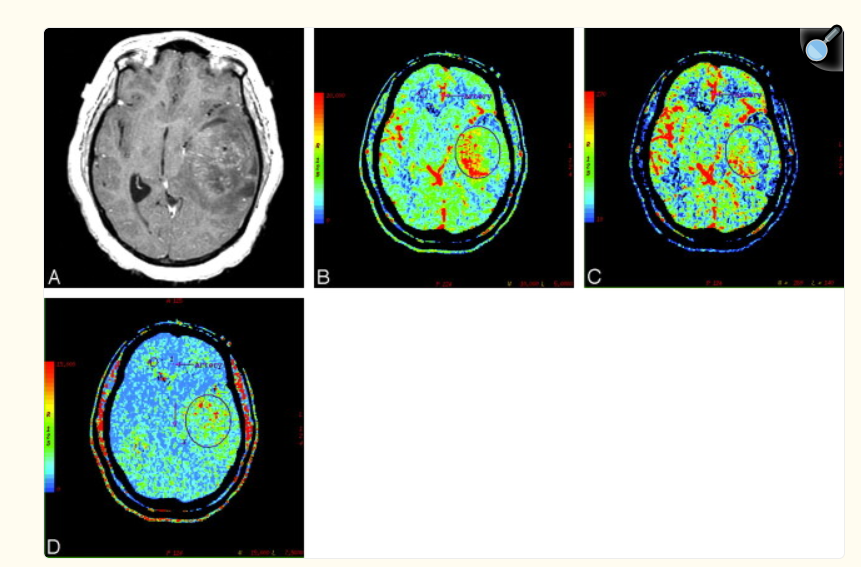
A, Image axiale en T1 après injection de produit de contraste montrant une grande lésion tumorale hétérogène au niveau temporal gauche, avec un effet de masse significatif.
B, Carte de volume sanguin cérébral (CBV) montrant un volume sanguin élevé (rCBV = 2,61).
C, Carte de débit sanguin cérébral (CBF) montrant un débit sanguin augmenté (rCBF = 1,65).
D, Carte de temps de transit moyen (MTT) montrant un MTT réduit (rMTT = 1,68) au sein de la tumeur.
Notez également la discordance entre les zones de volume sanguin et de débit sanguin accrus sur les cartes CBV/CBF et les zones de rehaussement au gadolinium.
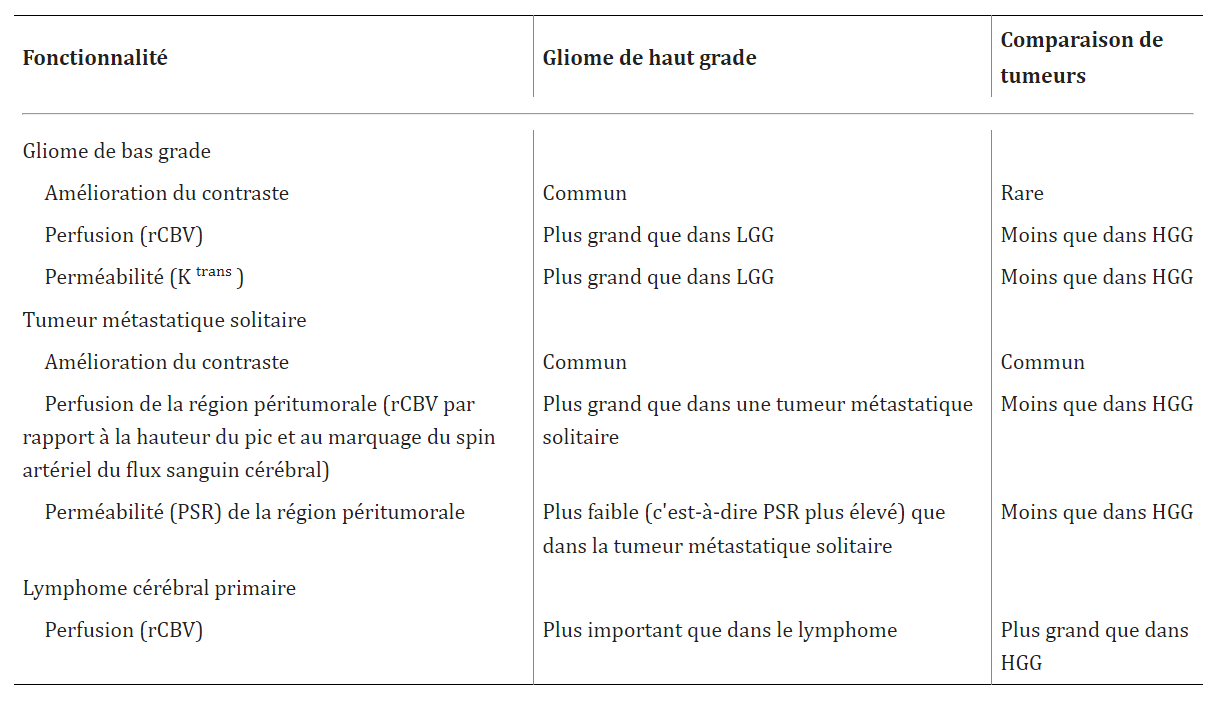
Gliome primaire versus tumeur cérébrale métastatique solitaire :
Les aspects d’imagerie conventionnels d’un gliome primaire et d’une tumeur métastatique cérébrale solitaire peuvent être assez similaires, et il peut être difficile de les différencier.
L’examen du rCBV dans la région péritumorale entourant une masse peut améliorer la différenciation de ces lésions. Le rCBV entourant un gliome de haut grade semble être plus grand que celui d’une tumeur métastatique solitaire [20].
La hauteur du pic de la région péritumorale dans le glioblastome est élevée par rapport à une lésion métastatique solitaire.
Le pourcentage de récupération de l’intensité du signal de la région péritumorale et de la région de contraste d’une lésion métastatique est également plus faible (perméabilité accrue) que dans un glioblastome.
La région péritumorale d’une tumeur métastatique est composée d’œdème vasogénique pur sans tumeur infiltrante. La région péritumorale d’un gliome de haut grade, cependant, est composée à la fois d’œdème vasogénique et de la tumeur infiltrante , qui peut s’étendre bien au-delà des marges hyperintenses T2 de la région péritumorale . [20]
Les différences de perméabilité peuvent s’expliquer par la constatation que les capillaires d’un glioblastome conservent une barrière hémato-encéphalique défectueuse, alors que la microvascularisation des lésions métastatiques ressemble aux capillaires normaux du tissu d’origine sans barrière hémato-encéphalique. [20]
Les résultats obtenus avec d’autres techniques de perfusion, telles que l’étiquetage du spin artériel (ASL) ont montré que le débit sanguin cérébral est significativement plus élevé dans la région péritumorale des glioblastomes par rapport aux lésions métastatiques [20] . (fig.46)
A et B, les images IRM conventionnelles montrent de multiples lésions cérébrales avec rehaussement après injection du gadolinium.
Le diagnostic différentiel d’une lésion temporale droite inclurait une tumeur primaire, une origine infectieuse et une maladie métastatique.
C, L’image de perfusion (0,1 mmol de gadobutrol à 5 mL/s) montre une augmentation du débit sanguin cérébral relatif, ce qui suggère une maladie métastatique.
Un adénocarcinome métastatique a été découvert lors de la chirurgie.
Glioblastome et lésions démyelinisantes :
Les lésions démyélinisantes tuméfactives sont définies comme des lésions cérébrales focales uniques ou multiples qui peuvent être cliniquement et radiologiquement impossibles à distinguer des tumeurs, ce qui constitue un défi diagnostique. Ces lésions présentent généralement, au stade aigu de développement, une amélioration périphérique du contraste, un œdème périlésionnel et un effet de masse, imitant les caractéristiques d’imagerie typiques du gliome de haut grade (glioblastome multiforme) [21].
Bien que la présence de certains signes d’imagerie suggère un diagnostic de lésions démyélinisantes tuméfiantes [22], qui peut être établi avec un degré élevé de certitude, il n’est pas rare qu’un diagnostic définitif nécessite une biopsie malgré une suspicion clinique de démyélinisation [23].
L’IRM DSC de perfusion a été utilisée pour distinguer les lésions démyélinisantes tuméfiantes actives des gliomes de haut grade et, par rapport à la spectroscopie IRM, peut être mieux mise en œuvre dans le bilan diagnostique de routine des lésions cérébrales d’origine inconnue car elle peut être facilement réalisée immédiatement avant l’acquisition d’images contrastées avec une augmentation minimale du temps d’examen.
Certaines études ont montré que l’IRM DSC peut être utilisée pour différencier les gliomes de grade 4 des lésions démyélinisantes tuméfiantes actives sur la base des résultats de l’analyse du rCBV [24]. (fig.47)
Cette différence peut s’expliquer par d’importantes différences biologiques entre ces deux types de lésions. Le gliome de grade 4 est caractérisé par la présence d’une néoangiogenèse et d’une prolifération endothéliale vasculaire, ce qui conduit à des augmentations substantielles du rCBV. Les lésions démyélinisantes tuméfactives sont cependant caractérisées par des vaisseaux intrinsèquement normaux ou enflammés avec seulement une angiogenèse inflammatoire légère [25], produisant une rCBV normale ou légèrement augmentée.
Il a été constaté que les valeurs de rCBV dans les lésions démyélinisantes tuméfactives aigues ne peuvent pas être utilisées pour différencier les lésions démyélinisantes tuméfactives actives des gliomes de grade 2 et 3 [ 26 ], car les deux types de lésions présentent une augmentation similaire de rCBV. (fig.48)
Cependant, les lésions démyélinisantes tuméfactives actives présentent généralement un défi diagnostique à l’IRM dans les gliomes de grade 4, mais pas dans les gliomes de grade 2 et 3.
A–C, L’image pondérée en T2 (A) et l’image T1 pondérée après contraste axiale (B) montrent une tumeur significativement rehaussée par le contraste, associée à un œdème péritumoral évident dans le lobe pariétal gauche.
C, L’image de CBV colorée corrélative montre des régions d’intérêt (ROI) (cercles). Les valeurs de CBV mesurées dans la ROI 1 sont de 258,6 ; ROI 2, 164,3 ; et ROI 3, 150,6, suggérant un gradient de rCBV dans la zone de bordure péritumorale (PBZ) depuis la proximité de la tumeur rehaussée jusqu’à la matière blanche non affectée.
A et B, homme de 64 ans atteint d’un gliome nécrotique de haut grade.
L’IRM pondérée en T1 avec contraste (A) montre un schéma de lésion similaire à celui de (C). La cartographie du volume sanguin cérébral acquise par IRM de perfusion à contraste de susceptibilité dynamique (0,1 mmol de gadobutrol) (B) ne montre cependant aucune augmentation de la perfusion.
C et D, femme de 47 ans atteinte d’une lésion inflammatoire-démyélinisante aiguë.
L’IRM pondérée en T1 avec contraste (C) montre un schéma lésionnel similaire à celui de A. La carte du volume sanguin cérébral acquise par IRM de perfusion à contraste de susceptibilité dynamique (0,1 mmol de gadobutrol) (D), montre cependant une nette augmentation du volume sanguin cérébral.
L’évaluation post thérapeutique d’un glioblastome : [15]
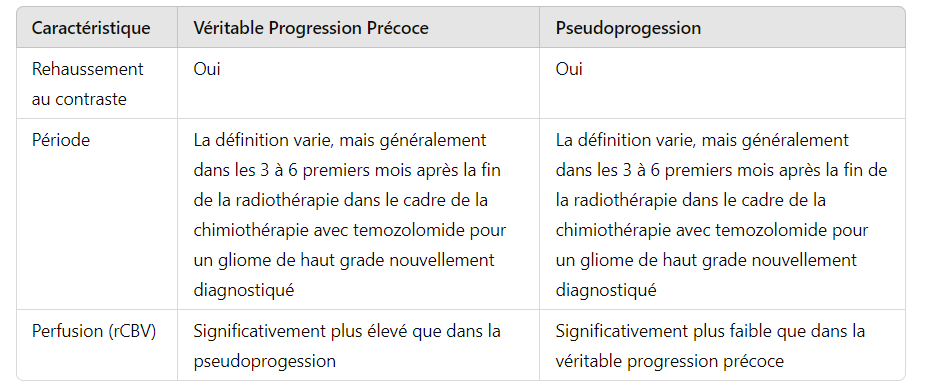
Les changements dans la zone 2D du rehaussement au contraste, connus sous le nom de critères de Macdonald constituent la méthode la plus couramment utilisée pour évaluer la réponse thérapeutique des gliomes de haut grade. Cependant, la dépendance au rehaussement au contraste pose problème car il s’agit d’un signe non spécifique qui reflète la rupture de la barrière hémato-encéphalique. Les lésions rehaussées après le traitement pourraient être dues à la tumeur, mais d’autres processus, tels que la nécrose radique, les changements post-chirurgicaux, les changements post-ictaux et les variations de la dose de stéroïdes, peuvent en être responsables.
Dans la littérature sur le glioblastome, la pseudoprogession et la pseudoréponse sont des préoccupations majeures qui ont attiré l’attention.
Dans la pseudoprogession, une augmentation transitoire du rehaussement au contraste est observée dans les 3 à 6 premiers mois après la fin de la radiothérapie dans le cadre du régime standard de chimiothérapie-radiothérapie avec temozolomide . L’utilisation de l’IRM conventionnelle avec contraste n’est pas suffisante pour différencier la pseudoprogession et la véritable progression précoce, aucune autre technique d’imagerie n’a été validée pour différencier ces deux entités. Les données semblent montrer que le rCBV est significativement plus élevé dans la véritable progression précoce par rapport à la pseudoprogession . En raison des préoccupations concernant l’effet de la fuite du contraste sur la précision du rCBV, l’utilisation d’un agent de pool sanguin, comme le ferumoxytol, au lieu d’un agent de contraste à base de gadolinium pourrait améliorer la différenciation de la pseudoprogession et de la véritable progression précoce (Tableau 6).
Les lymphomes cérébraux :
Les lymphomes cérébraux primitifs se développent fréquemment au niveau du parenchyme cérébral ou au niveau de la moelle épinière. L’incidence des lymphomes cérébraux primaires (LCP) a considérablement augmenté au cours des trois dernières décennies et représente environ 6 % de l’ensemble des tumeurs. Les LCP sont des néoplasmes agressifs chez les sujets immunocompétents et immunodéprimés. La sémiologie IRM des lymphomes cérébraux secondaires est similaire à celle des lymphomes cérébraux primitifs. La plupart des lymphomes primitifs du système nerveux sont iso-intenses ou hypo-intenses en séquences T2 et se rehaussent de façon homogène.
Le lymphome cérébral primaire peut ressembler à un gliome de haut grade et à d’autres tumeurs de haut grade à l’IRM conventionnelle avec contraste [62]. En raison de l’absence d’angiogenèse frappante habituellement observée dans les gliomes de haut grade, les lymphomes ont un rCBV inférieure à celle des gliomes de haut grade [65]
Évoquer le diagnostic de lymphome dès l’IRM permet de ne pas initier une corticothérapie qui pourrait effacer la lésion et rendre la biopsie impossible. Le lymphome présente des caractéristiques en diffusion comme en perfusion : en diffusion, il existe un abaissement de l’ADC lié au caractère très cellulaire de la tumeur et en perfusion, le rCBV est bas,
Proche de 1,5 [49,50] et la ligne de base passe très nettement au-dessus de sa valeur initiale. Ces données sont particulièrement utiles pour identifier les formes méningées des lymphomes qui se distinguent ainsi des méningiomes et des métastases méningées et pour reconnaître les localisations lymphomateuses multiples [92]. (fig.49)
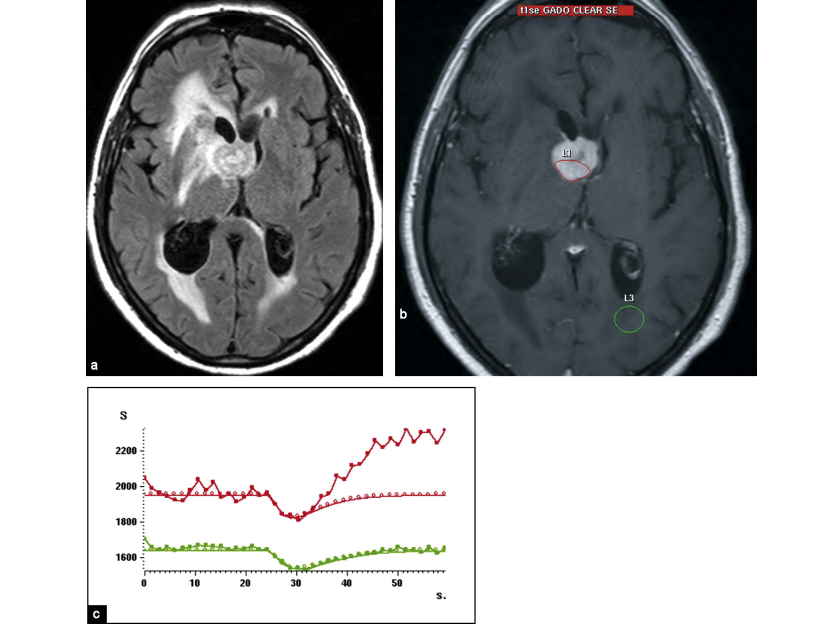
a : lésion obstructive des trous de Monro
b : la masse prend massivement le contraste
c : ratio de volume sanguin cérébral (VSC) légèrement inférieur à 1 et importante perméabilité des vaisseaux tumoraux (passage au-dessus de la ligne de base de la courbe de perfusion très prononcé).
Les gliomes et les lymphomes cérébraux :
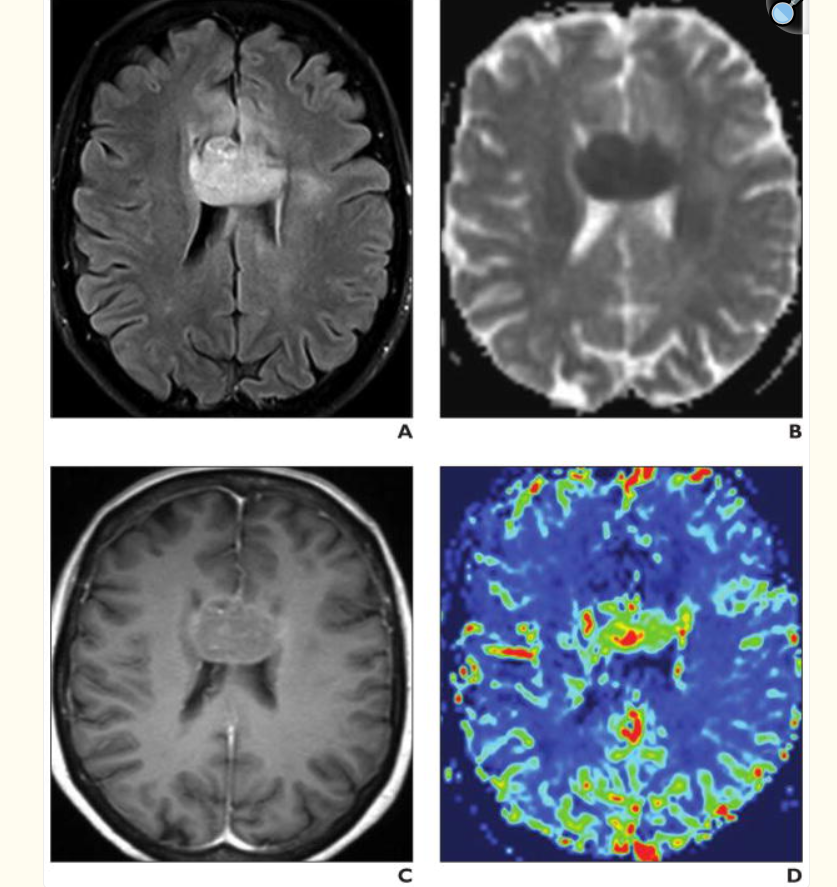
Le lymphome cérébral primaire peut apparaître similaire à un gliome de haut grade et à d’autres tumeurs de haut grade lors de l’IRM conventionnelle avec rehaussement au contraste. En raison de l’absence de l’angiogenèse marquante généralement observée dans les gliomes de haut grade, les lymphomes présentent un rCBV inférieur à celui des gliomes de haut grade [94].
- L’IRM cérébrale comprend l’image FLAIR transversale en T2.
- la carte du coefficient de diffusion apparent (ADC).
- l’image transversale en T1 après injection de contraste (0,1 mmol de gadobutrol).
- la carte du volume sanguin cérébral relatif (rCBV).
La masse homogène du corps calleux est hypointense sur la carte ADC, ce qui est compatible avec une diffusion restreinte. Un faible captage du contraste et une intensité du signal accrue sur la carte de couleur rCBV indiquent une hyperperfusion .
-Médulloblastomes:
Les médulloblastomes sont des tumeurs neuroépithéliales embryonnaires agressives, développées au niveau du cervelet ou de la partie postérieure du tronc cérébral. Les médulloblastomes représentent 15 à 20 % des tumeurs du système nerveux central avant l’âge de 15 ans et un tiers des tumeurs de la fosse postérieure, avec une incidence de 6 nouveaux cas par million d’habitants et par année.
L’IRM a un rôle très important pour le diagnostic topographique, étiologique de la tumeur ainsi que pour la recherche d’une dissémination sous-arachnoïdienne [40, 41,42].
En IRM, le médulloblastome classique apparaît hypointense en T1 et hyperintense en densité protonique, en T2 et en FLAIR, en restriction sur la séquence de diffusion, des zones nécrotiques et kystiques sont notées dans plus de 50 % des cas.
Trois techniques d’imagerie par perfusion (PWI) ont été utilisées pour évaluer le médulloblastome [43] : l’IRM dynamique avec contraste par matériel de susceptibilité T2*, l’IRM dynamique avec contraste T1 et le marquage par spin artériel (ASL).
Avec le DSC, le rCBV est élevé dans la plupart des rapports [44, 45,46–47]. Le coefficient de fuite K2 a été rapporté comme élevé [48]. Contrairement aux autres techniques, l’ASL ne nécessite pas d’injection de contraste, ce qui est très pertinent pour la population pédiatrique. Deux études chez les enfants ont rapporté un flux sanguin cérébral (CBF) élevé (médiane de 59 mL/min/100 g) et un CBF relatif (1,36 et 2,87) dans les médulloblastomes supérieur à celui des astrocytomes pilocytaires, mais pas différent de celui des épendymomes [49,50]. Cependant, ces valeurs variaient entre les patients et se chevauchaient avec celles des astrocytomes pilocytaires . Ce problème a été surmonté en utilisant également l’amélioration du contraste de la tumeur : pour le même CBF, les médulloblastomes montraient une amélioration beaucoup plus faible que les astrocytomes pilocytaires [49]. (fig.51)
Le suivi post-thérapeutique est fait sur la base d’une surveillance IRM crânienne et rachidienne chaque six mois dans les cinq premières années, puis sur une surveillance annuelle par la suite. L’imagerie de diffusion, démontre une diminution de l’ADC, et permet de dépister des récidives non identifiées par l’injection de gadolinium, du fait d’une absence de rehaussement. [50, 51]
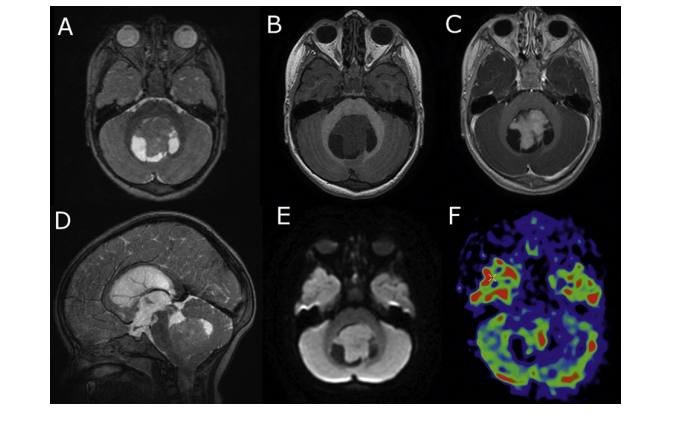
A. Axiale pondérée T2, B. Axiale pondérée T1, C. Axiale pondérée T1 après injection de chélate de gadolinium, D. Sagittale pondérée T2, E. Axiale pondérée en diffusion. F. Carte du flux sanguin cérébral utilisant le marquage par spin artériel.
L’examen montre une tumeur médiane avec un signal hétérogène en T2 (hypo et isosignal). A. Changements kystiques. B. Hypersignal en T1. C. Forte amélioration après injection. D. L’effet de masse sur le quatrième ventricule est responsable d’une hydrocéphalie non communicante avec dilatation du troisième ventricule. E.
La tumeur présente un signal élevé et une restriction de diffusion sur l’imagerie en diffusion. F. Le flux sanguin cérébral est élevé au sein de la tumeur (88 mL/min/100 g). [43].
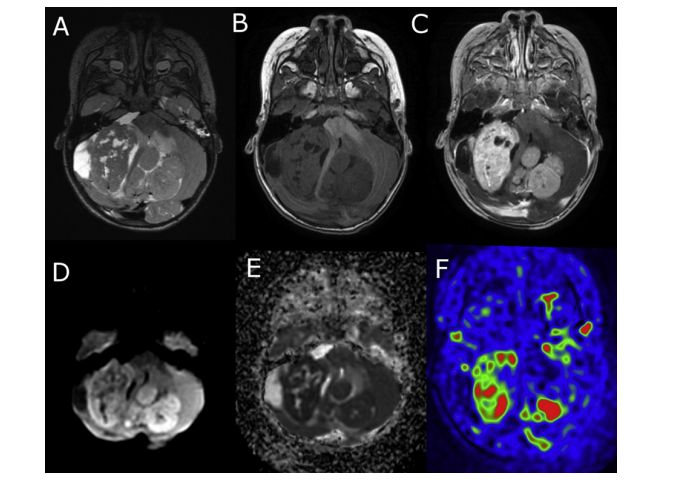
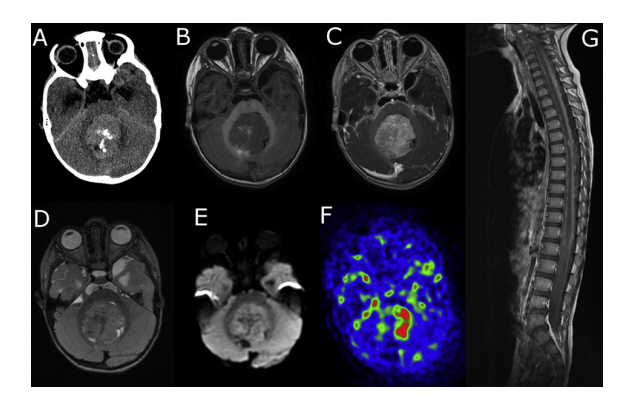
Images IRM : A. Axiale pondérée T2, B. Axiale pondérée T1, C. Axiale pondérée T1 après injection de chélate de gadolinium, D. Axiale pondérée en diffusion, E. Carte du coefficient de diffusion apparent, F. Carte du flux sanguin cérébral utilisant le marquage par spin artériel. L’examen montre des tumeurs bifocales dans les hémisphères cérébelleux, avec un signal hétérogène en T2 (hyper et isosignal). A. Changements kystiques et nécrotiques. B. Hypersignal en T1. C. Forte amélioration après injection. D. Un œdème avec une petite extension est observé à la bordure antérieure gauche de la tumeur. D, E. La tumeur présente un signal élevé et une restriction de diffusion sur l’imagerie en diffusion. F. Le flux sanguin cérébral est très élevé au sein de la tumeur (152 mL/min/100 g). [43].
Images IRM : A. coupe axiale avec produit de contraste, B. Axiale pondérée T1, C. Axiale pondérée T1 après injection de chélate de gadolinium, D. Axiale pondérée T2, E. Axiale pondérée en diffusion, F. Carte du flux sanguin cérébral utilisant le marquage par spin artériel, G. Sagittale pondérée T1 après injection de chélate de gadolinium.
A. L’examen montre une tumeur médiane, affichant des calcifications hétérogènes, B. Hypersignal en T1 (sauf les calcifications montrant un hypersignal), C. Forte amélioration après injection, D. Signal hétérogène en T2 (hypo et isosignal), E. La tumeur présente un signal intermédiaire sur l’imagerie en diffusion, F. Le flux sanguin cérébral est élevé au sein de la tumeur (90 mL/min/100 g), G. Une métastase leptomeningée diffuse peut être observée le long des citernes basales (amélioration épaisse diffuse) et sur l’ensemble de la moelle épinière (amélioration épaisse et nodulaire).
Les astrocytomes :
Le système nerveux central est composé de neurones et de cellules gliales. Parmi ces cellules gliales, on trouve des cellules appelées astrocytes qui jouent un rôle essentiel dans la nutrition et le bon fonctionnement des neurones.
Ces astrocytes peuvent perdre leurs normalités et donner naissance à des tumeurs appelées Astrocytomes qui peuvent avoir la même apparence radiologique que des lésions infectieuses ou d’autres types de tumeurs.
Les astrocytomes sont classifiés sur une échelle allant de 1 à 4. Les tumeurs de grade 1 ont une croissance lente et sont composés de cellules ayant encore une certaine ressemblance avec des astrocytes. Les tumeurs de grade 4 ont une croissance rapide et un aspect anarchique. Ce sont des tumeurs hautement malignes.
Chez les adultes, les astrocytomes anaplasiques infiltrent le plus souvent la substance blanche des lobes temporaux et frontaux. Ce type de tumeur est le plus souvent trouvé dans la cinquantaine.
Le caractère infiltrant de la tumeur est telle que « l’hyperintensité péritumorale » sur les séquences pondérées en T2 en IRM reflète souvent la coexistence d’un oedème et la présence de cellules tumorales. [95] (fig.54)
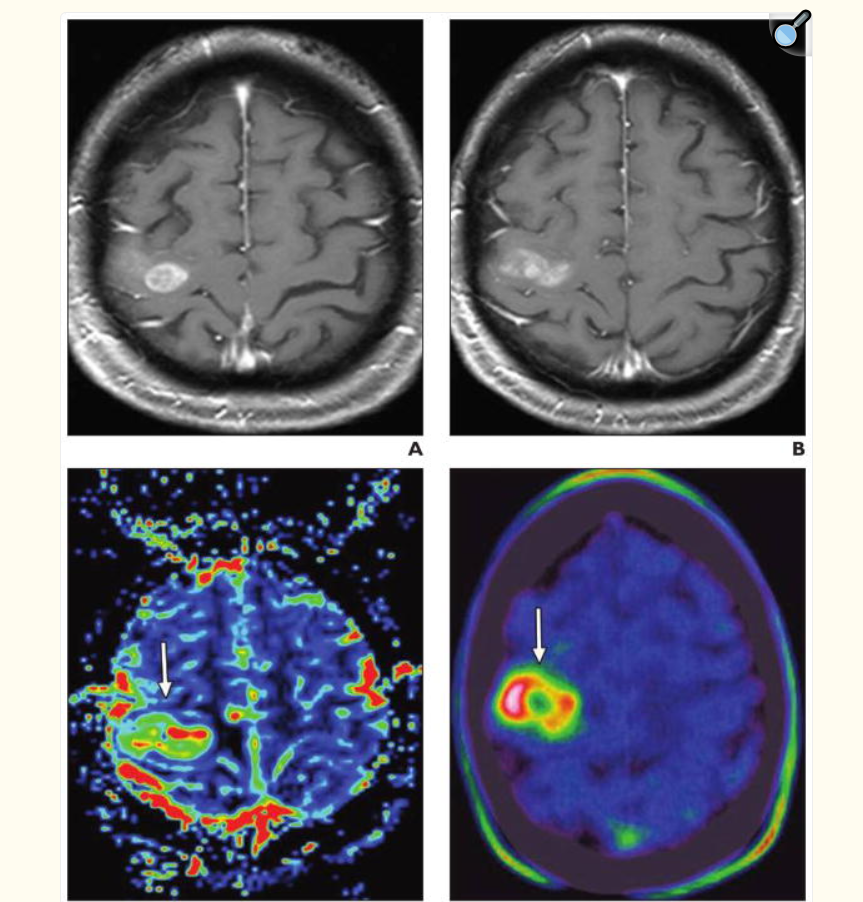
A et B, Les images IRM conventionnelles (A et B, sections différentes) montrent une lésion hétérogène avec rehaussement et un effet de masse minimal.
C et D, La carte du débit sanguin cérébral relatif (C) dérivée de l’IRM de perfusion avec contraste de Susceptibilité dynamique (0,1 mmol de gadobutrol injecté à 5 mL/s avec un lavage de 20 mL de solution saline) sont corrélées aux résultats de la PET (D), montrant la tumeur (flèche) avec un taux de perfusion élevé, basé sur une forte prolifération.
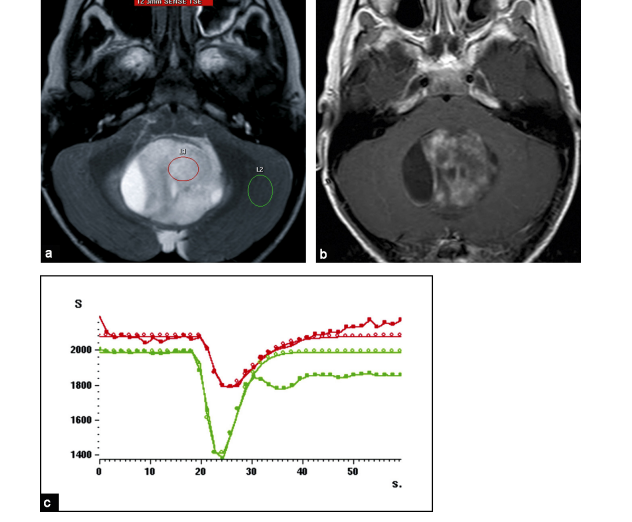
a : masse accolée au quatrième ventricule.
b : la masse prend le contraste de façon hétérogène.
c : les courbes de perfusion en zone saine (verte) et tumorale (rouge) ne mettent pas en évidence d’augmentation du rCBV dans la tumeur, mais une augmentation de la perméabilité (passage au-dessus de la ligne de base de la courbe de perfusion).
Les complications de la radiothérapie
Différenciation entre tumeur récurrente et nécrose radiologique retardée
Il est essentiel de différencier une tumeur récurrente et une nécrose radique retardée, car leurs stratégies de prise en charge sont très différentes. Les patients atteints d’une tumeur récurrente peuvent subir une intervention chirurgicale supplémentaire, une chimiothérapie et une radiothérapie, tandis que ceux atteints d’une nécrose radique retardée peuvent être traités de manière conservatrice par stéroïdes. L’IRM conventionnelle avec contraste n’est pas fiable pour différencier une nécrose radique retardée d’une tumeur récurrente, car les deux peuvent apparaître comme une masse avec contraste entourée d’œdème [52].
La rCBV semble être élevée chez les patients atteints d’une tumeur récurrente par rapport à la rCBV chez les patients atteints d’une nécrose radique retardée, ce qui reflète probablement la prolifération vasculaire accrue et les capillaires qui fuient de la tumeur récurrente, tandis que la nécrose radique retardée est composée d’une nécrose fibrinoïde étendue, d’une dilatation vasculaire et d’une lésion endothéliale [55, 53 –54].
Une augmentation de la hauteur du pic et de la rCBV et une récupération de l’intensité du signal en pourcentage relatif plus faible dans le glioblastome récurrent que dans la nécrose radique retardée.
L’expérience avec l’IRM-DSC dans le contexte de la nécrose radique retardée est limitée mais semble également indiquer que la nécrose radique retardée a une perméabilité inférieure à celle de la tumeur récurrente [56]. (fig.56)
A noter que la progression tumorale présente un rCBV supérieur à 2.6 et une radionécrose présente un rCBV inferieur 0.6-1.5. (Tableau 7)
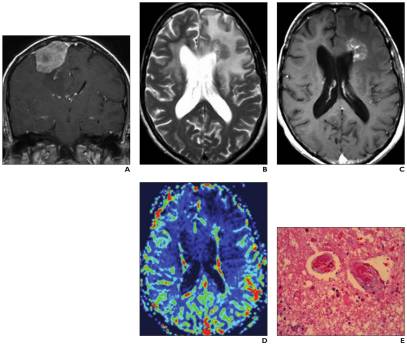
A. Une image IRM pondérée en T1 avec contraste coronal montre un méningiome malin convexe frontal droit.
B–D, Deux ans après la radiothérapie, le patient a présenté des céphalées progressives, une confusion, des changements de comportement et une incontinence urinaire.
Les images transversales pondérées en T2 (B) et Pondérées en T1 avec contraste (C) .La carte du volume sanguin cérébral relatif (D) (0,1 mmol/kg de gadobutrol à 5 ml/s) montrent des modifications diffuses de la substance blanche induites par la radiothérapie dans les deux lobes frontaux et une masse nécrotique profonde du lobe frontal gauche avec une prise de contraste irrégulière et une faible intensité du signal en D, indiquant une hypoperfusion. E, La photomicrographie (H et E, ×40) obtenue en même temps que B–D montre des caractéristiques typiques de nécrose de coagulation avec des changements vasculaires profonds, y compris une nécrose fibrinoïde et une hyalinisation de la paroi et une occlusion de la lumière par des thrombus de fibrine.
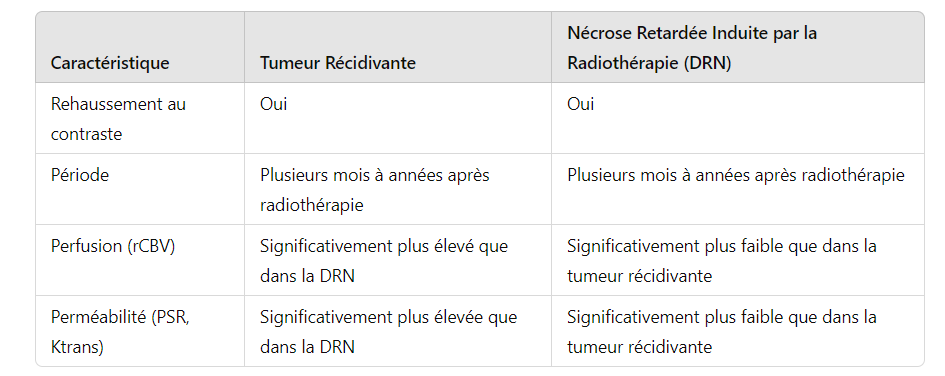
Tumeurs extra-axiales:
Le diagnostic est facile pour les tumeurs extra-axiales de petite taille qui sont séparées du cortex cérébral par du LCR. La confrontation des données d’IRM à une exploration scanographique sans injection est indispensable pour l’analyse de la voûte ou de la base du crâne ou encore pour l’identification de calcifications situées à proximité de la voûte.
Les tumeurs extra-axiales sont représentées par les tumeurs des méninges, les tumeurs développées sur le trajet des nerfs crâniens, les tumeurs kystiques et les tumeurs osseuses. [58,59]
*Les Méningiomes:
Les méningiomes sont des tumeurs très fréquents, représentent près de 20 % des tumeurs intracrâniennes opérées, plus fréquent chez la femme de plus de 45 ans. Parmi les facteurs prédisposant, une neurofibromatose de type 2, une radiothérapie. Une première crise d’épilepsie révèle souvent un méningiome. Leur localisation au niveau extra axiale facilite leur diagnostic. Selon la classification de l’OMS, les différences entre Les méningiomes bénins et atypiques/malins sont liées au nombre de mitoses, à la cellularité et au rapport noyaux-cytoplasmes ainsi qu’à leurs caractéristiques histologiques. [60]
Quel que soit le grade, les méningiomes sont très vascularisés. Les capillaires de la tumeur sont perméables, ce qui permet une fuite de contraste sur les images de perfusion. L’IRM conventionnelle fournit des informations utiles concernant la localisation et la morphologie.
L’utilité des techniques de diffusion et de perfusion est d’étudier le classement des méningiomes, et la différenciation des sous-types bénins et atypiques/malins.
Bien que, en général, les méningiomes soient bénins, ils peuvent avoir un rCBV beaucoup plus élevé que les tumeurs intra axiales. (Tableau 8)
Cela est probablement dû à leur vascularisation marquée et à l’absence totale de barrière hémato-encéphalique dans ces tumeurs, ce qui peut produire des valeurs de rCBV faussement élevées ou basses [62].
L’IRM DSC a été utilisée pour caractériser l’apport sanguin des méningiomes [63]. L’apport sanguin typique d’un méningiome bénin provient des branches durales de l’artère carotide externe. Ces vaisseaux n’ont pas de barrière hémato-encéphalique et, par conséquent, les courbes intensités du signal–temps montrent peu ou pas de retour de l’intensité du signal à la ligne de base après le premier passage de l’agent de contraste à base de gadolinium.
La parasitisation des artères piales se produit lorsque le méningiome s’agrandit. Ces artères ont une barrière hémato-encéphalique et présentent donc un retour plus important de l’intensité du signal de base après le premier passage. Les méningiomes, qui ont un apport sanguin plus important, ont tendance à être plus agressifs et à récidiver à des taux plus élevés [63] même la surveillance post chirurgicale est basée sur une exploration IRM en utilisant systématiquement des coupes en FLAIR et en T1 après injection de gadolinium. [64,19]
La classification de la World Health Organization of Tumors dénombre 15 sous-types de méningiomes. Il est donc difficile de décrire des critères généraux de vascularisation de l’ensemble des méningiomes. Le rCBV des méningiomes angiomateux est supérieur à celui des méningiomes méningothéliaux, lui-même supérieur à celui des méningiomes fibroblastiques [96]. Un rCBV élevé dans l’œdème périlésionnel oriente vers un méningiome anaplasique [97]. En pratique médicale, une tumeur extra-axiale très hypervascularisée est en faveur d’un méningiome plutôt que d’un schwannome [98] ou d’une métastase durale [56], bien que des métastases hypervasculaires puissent induire en erreur. Une tumeur intraventriculaire très hypervascularisée est en faveur d’un méningiome plutôt que d’un neurocytome ou un subépendymome. (fig. 57)
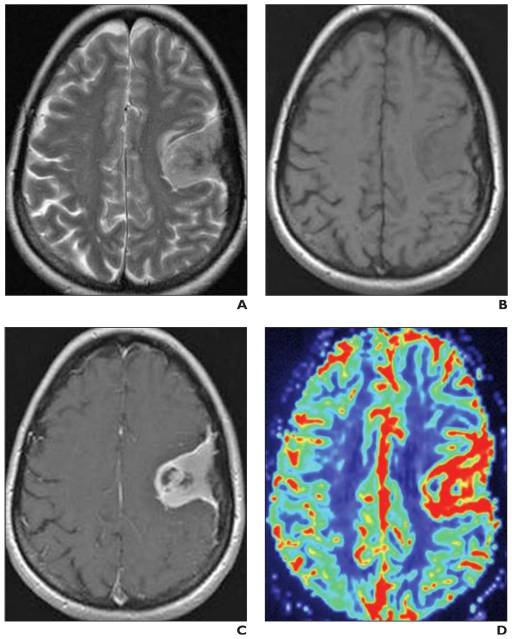
Images IRM : l’IRM cérébrale comprend une image transversale pondérée en T2 (A), Des images transversales non rehaussées (B) . Pondérées en T1 avec contraste (C).
Une carte transversale du rCBV (D) (0,1 mmol de gadobutrol à 5 ml/s).
La masse frontale gauche convexe rehaussée montre de petites zones de nécrose et une intensité de signal accrue sur la carte couleur du rCBV, indiquant une hyperperfusion.
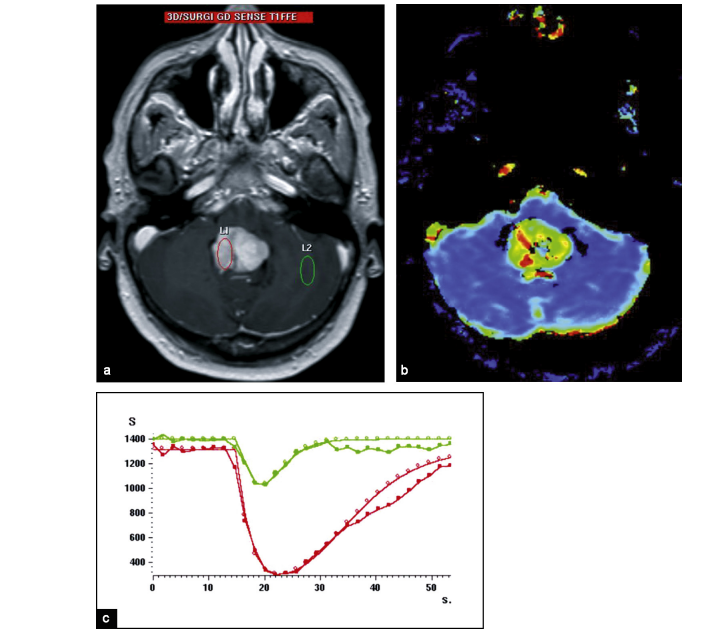
a : la masse prend le contraste de façon homogène.
b : elle est hypervasculaire sur la cartographie du volume sanguin cérébral (VSC).
c : son ratio de VSC est égal à 15.
Métastases cérébrales
Les métastases cérébrales sont les plus fréquents des tumeurs du cerveau. Les cancers bronchiques, mammaires, les mélanomes, les cancers du rein et les cancers colorectaux sont les cancers d’origine les plus fréquents. La sémiologie en IRM est peu spécifique. Les métastases cérébrales révèlent le cancer primitif devant une symptomatologie neurologique, la lésion peut être unique ou, sous forme de masses multiples le plus souvent, ou cours du traitement de la tumeur primitive, ou rester asymptomatiques. [66]. L’imagerie joue un rôle primordial dans le diagnostic et la surveillance thérapeutique des lésions. L’imagerie par résonnance magnétique est supérieure à la TDM pour poser un diagnostic précoce des lésions de petite taille et aussi pour caractériser une topographique précise. L’IRM est indiquée pour la confirmation du caractère unique d’une suspicion de métastase en vue de son exérèse ou à confirmer une lésion devant la présence d’anomalies densitométriques, aide aussi pour différencier une métastase d’un foyer ischémique ou d’un angiome caverneux ou lors d’une discordance entre la présence de symptômes cliniques neurologiques alors que le scanner est normal [67]. En IRM, les métastases cérébrales sont des lésions bien limitées, en hyposignal en T1, hypersignal en T2, et se rehaussent après injection de manière nodulaire en raison de la présence d’une composante nécrotique fréquente. La nécrose centrale est très fortement hyperintense en T2, et peut apparaître le plus souvent hypointense en FLAIR.
Les métastases cérébrales provenant de divers sites de tumeurs primaires ont également été évaluées à l’aide de techniques de perfusion et comparées aux tumeurs cérébrales primaires, avec des études montrant que les lésions métastatiques tendent à avoir un rCBV élevé. (fig.56)
Très fréquentes, les métastases cérébrales sont volontiers hypervasculaires, si elles sont uniques et si aucun antécédent néoplasique n’est connu, le diagnostic différentiel avec un processus tumoral glial malin est difficile. Le PSR des métastases et statistiquement plus bas que celui des gliomes malins [99]. L’étude de l’environnement péritumoral permet d’orienter vers l’une ou l’autre des deux hypothèses diagnostiques. Le rCBV observé en zone péritumorale en cas de métastase est plus bas que celui observé en cas de gliome malin [100] en raison de l’infiltration tumorale périlésionnelle observée en cas de gliome. Ce signe séméiologique, quand il existe, semble en pratique clinique le plus fiable pour différencier les deux entités tumorales.
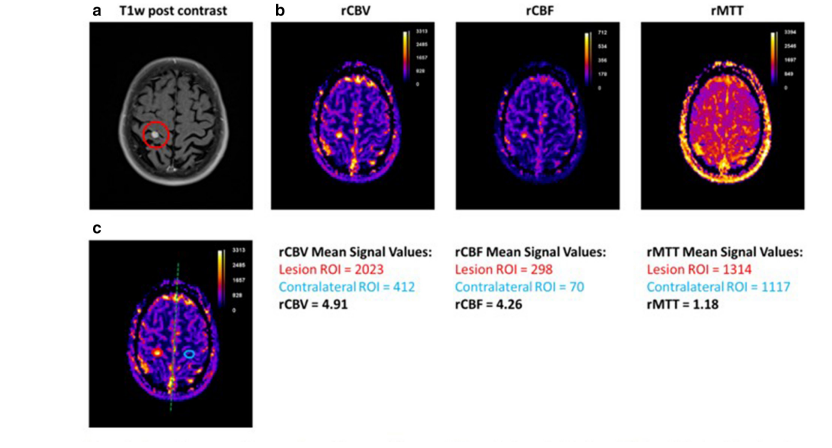
(a) Scan post-contraste en T1 montrant une lésion rehaussée dans le lobe frontal droit.
(b) Cartes paramétriques pour rCBV, rCBF et rMTT calculées à partir des données de perfusion, les barres de l’échelle sont indiquées sur chaque image.
(c) Exemple de la manière dont les valeurs sont calculées par lésion puis miroir sur le côté contralatéral du cerveau. Les valeurs calculées sont indiquées sous forme de rapports pour ce cas pour chaque paramètre.
2. Orientation des biopsies : [15]
La biopsie des tumeurs cérébrales est guidée soit par tomodensitométrie avec contraste, soit par imagerie par résonance magnétique.
La portion la plus maligne de la tumeur ne montre pas nécessairement de rehaussement au contraste. Les cartes de rCBV peuvent être utilisées pour mieux sélectionner les régions de plus haut grade afin de cibler la biopsie car le foyer le plus hyperperfusé au sein du processus tumoral c’est la zone suspecte de plus haute malignité.
Difference entre l’ASL et le DSC
La DSC et l’ASL peuvent distinguer les tumeurs cérébrales pédiatriques de bas et de haut grade, mais leur précision dépend de la localisation de la tumeur et de la force du champ magnétique.
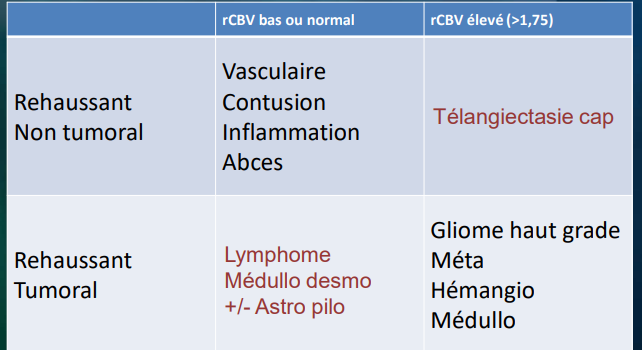
La DSC est plus performante que l’ASL, avec d’excellents résultats pour les tumeurs sus tentorielles. En revanche, l’ASL semble mieux fonctionner dans la fosse postérieure. Les paramètres temporels de la DSC apparaissent comme une alternative pertinente aux paramètres conventionnels (débit sanguin cérébral et volume sanguin cérébral) dans la localisation sous tentorielle. [68]
3. Quels protocoles spécifiques peuvent être utilisés pour l’IRM de perfusion cérébrale ?
L’intégration des techniques de perfusion dans un protocole moderne de neuroimagerie n’est pas complexe, mais elle présente quelques prérequis et nécessite l’utilisation de produits de contraste et de techniques d’injection spécifiques. Les protocoles typiques pour l’imagerie des tumeurs cérébrales sont représentés sur l’appendice 1.
Les exigences pour le système IRM ne sont pas particulièrement spécifiques. Toutefois, comme les techniques de perfusion ASL et DSC reposent sur des techniques d’écho-planar, l’unité IRM doit permettre ces acquisitions rapides. Pour une acquisition rapide dans l’IRM de perfusion avec contraste et l’angiographie par IRM, une injection automatisée du contraste est recommandée.
Appendice 1.
Protocole pour les tumeurs cérébrales
Protocole IRM standardisé (par ordre d’acquisition) :
- T1 pondéré sans contraste (écho de spin ou écho de gradient).
- T2 pondéré axial (spin-écho rapide).
- FLAIR (facultatif après l’administration du contraste).
- Imagerie par diffusion ou imagerie par tenseur de diffusion (pour l’extraction des données de diffusion et du coefficient de diffusion apparent à partir de l’imagerie par tenseur de diffusion).
- Carte T1 pondéré (quantification) pour l’IRM dynamique avec contraste : Imagerie 3D T1-écho de gradient ou 2D turbo spin-écho de T1-écho rapide.
- Imagerie par contraste dynamique de susceptibilité (T2*) après la séquence de pré-saturation dynamique avec contraste.
- Séquence T1 pondéré avec contraste (écho de spin ou écho de gradient).
Optionnel :
- Tests fonctionnels (langage, audition, vision, motricité) et spectroscopie par IRM
Commentaires :
- FLAIR peut être réalisé avant l’IRM dynamique de susceptibilité avec contraste
- Imagerie pondérée par susceptibilité et écho de gradient comme séquences additionnelles optionnelles
Recommandations générales des paramètres :
- Épaisseur de coupe minimale : 5 mm
- Durée cible ≤ 30 min (maximum : 1,5-2,0 h)
Tableau récapitulatif :
Tableau 10:Techniques d’IRM et leur objectif dans l’imagerie des tumeurs cérébrales
|
Tech. IRM |
Utilité Clinique |
|
T1 |
Évalue l’architecture des tissus. |
|
T2/FLAIR |
Évalue l’architecture des tissus. |
|
T2* (SWI) |
Sensible à la susceptibilité magnétique. |
|
Diffusion (DWI/ADC) |
Analyse le mouvement aléatoire/la diffusion de l’eau. |
|
MME (Spectroscopie) |
Évalue le profil biochimique/métabolique de la tumeur. |
|
Perfusion |
DSC — mesure le volume sanguin cérébral. |
|
DTI (Imagerie par tenseur de diffusion) |
Analyse la direction de la diffusivité et l’orientation des faisceaux de matière blanche. |
|
IRM fonctionnelle (IRMf) |
Évalue l’activation cérébrale en détectant les altérations du niveau d’oxygénation du sang. |